
分析 (1)摩尔质量以g/mol为单位,数值上等于其相对分子质量;根据n=$\frac{m}{M}$计算水的物质的量;根据V=nVm计算氧气体积;根据n=$\frac{m}{M}$计算NaOH的物质的量,再根据c=$\frac{n}{V}$计算溶液物质的量浓度;
(2)根据氯离子物质的量计算RCl2的物质的量,再根据M=$\frac{m}{n}$计算其摩尔质量,进而计算A的相对原子质量.
解答 解:(1)二氧化碳的相对分子质量为44,则二氧化碳摩尔质量为44 g•mol-1;
水的摩尔质量为18g/mol,9g水的物质的量是$\frac{9g}{18g/mol}$=0.5mol;
0.5molO2在标准状况下的体积约为0.5mol×22.4L/mol=11.2L;约含有0.5mol×2×NA=NA,20g烧碱的物质的量为$\frac{20g}{40g/mol}$=0.5mol,配制成500mL溶液,其物质的量浓度为$\frac{0.5mol}{0.5L}$=1mol/L.
故答案为:44 g•mol-1; 0.5mol;11.2L;NA;1;
(2)19g某二价金属氯化物(RCl2)中含有0.4mol Cl-,则RCl2的物质的量为$\frac{0.4mol}{2}$=0.2mol,RCl2的摩尔质量是$\frac{19g}{0.2mol}$=95 g•mol-1,相对分子质量是为95,则R的相对原子质量为95-35.5×2=24,
故答案为:95 g•mol-1;24.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心有关计算,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 从左向右数第六纵行是ⅥA族 | B. | 七个周期18个族 | ||
| C. | ⅠA族全部是金属元素 | D. | 所含元素种类最多的族是ⅢB族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  实验测定氯水的pH | |
| B. | 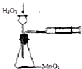 实验定量测定H2O2的分解速率 | |
| C. | 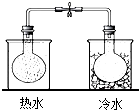 实验中利用NO2颜色的变化验证其中反应的热效应 | |
| D. | 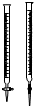 实验中(乙)管内盛放已知浓度的KMnO4溶液来测定FeSO4溶液的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 | B. | NaHCO3 | C. | Na2CO3 和NaHCO3 | D. | NaOH和Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150ml 1mol/L的NaCl溶液 | B. | 150ml 3mol/LKCl溶液 | ||
| C. | 75ml 2mol/L的NH4Cl溶液 | D. | 50ml 1mol/lCuCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 I2在KI溶液中存在平衡:I2(aq)+I-(aq)═I3- (aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如下.下列说法不正确的是( )
I2在KI溶液中存在平衡:I2(aq)+I-(aq)═I3- (aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如下.下列说法不正确的是( )| A. | 反应I2(aq)+I-(aq)═I3- (aq)的△H>0 | |
| B. | 若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2 | |
| C. | 若反应进行到状态D时,一定有v正>v逆 | |
| D. | 状态A与状态B相比,状态A的c(I2) 小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
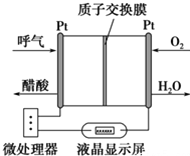 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )| A. | 该电池的负极反应式为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ | |
| B. | 该电池的正极反应式为:O2+4e-+4H+═2H2O | |
| C. | 电流由O2所在的铂电极经外电路流向另一电极 | |
| D. | 微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:D>C>B>A | B. | 氢化物的稳定性:H2C>HD | ||
| C. | 离子半径:C2->D->B+>A2+ | D. | 氧化性:A2+>B+,还原性:C2-<D- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol•L-1) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol•L-1) | c1 | c2 | 0.4 |
| A. | 10 min内,v(Cl2)=0.04 mol•L-1•min-1 | |
| B. | 当容器中Cl2为1.2 mol时,反应达到平衡 | |
| C. | 升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3$\frac{△n({T}_{1})}{△n({T}_{2})}$<1 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件再达平衡时,c(PCl5)<0.2 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com