
【题目】氮及其化合物在人们的日常生活、生产和环保事业中属于“明星物质”。回答下列问题:
(1)氨气是农业肥料和化工生产的重要原料,其电子式为____。
(2)叠氮化钠(NaN3)在药物制备、合成影像、化学分析、汽车制造等行业有着广泛的用途,但该物质极易爆炸,且有副毒。可用NaClO溶液对含有叠氮化钠的溶液进行处理,生成一种无污染的气体单质,反应的化学方程式为______________。
(3)“固氮”是农业科学家研究的永恒主题。在某特殊催化剂和光照条件下,N2与水反应可生成NH3。
已知:
(i)4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H1=-1266 kJ/mol;
2N2(g) +6H2O(g) △H1=-1266 kJ/mol;
(ii)H2O(g)=H2O(l) △H2= -44.0kJ/mol。
则2N2(g) +6H2O(l)![]() 4NH3(g)+3O2(g) △H3=______kJ/mol。
4NH3(g)+3O2(g) △H3=______kJ/mol。
(4)目前“人工固氮”最成功的应用就是工业合成氨:
N2(g) +3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol。将1.00molN2和3.00molH2充入到容积为3L的恒容密闭容器中,发生上述反应。
2NH3(g) △H=-92.4kJ/mol。将1.00molN2和3.00molH2充入到容积为3L的恒容密闭容器中,发生上述反应。

①图甲是测得X、Y 的浓度随时间变化的曲线.其中Y 为_____(写化学式),反应达到平衡时的平均反应速率v(N2) =_________。
②在不同温度和压强下,平衡体系中NH3的体积分数与温度、压强关系如图乙,则压强p1_____p2(填“>”“<”“=”或“不确定”,下同),B、D 两点的平衡常数KB____KD,B 点N2 的转化率=_________(保留3位有效数字)。
(5)“绿水青山就是金山银山”,利用原电池原理(6NO2 +8NH3=7N2+12H2O)可以处理氮的氧化物和NH3 尾气,装置原理图如图丙:

负极反应式为__________,当有标准状况下4.48 L NO2被处理时,转移电子的物质的量为_____mol。
【答案】  NaClO+2NaN3+ H2O=NaCl +2NaOH +3N2↑ +1 530 H2 0.025 mol· L-1· min-1 < > 82.4% 2NH3 -6e- +6OH-=N2+6H2O 0.8
NaClO+2NaN3+ H2O=NaCl +2NaOH +3N2↑ +1 530 H2 0.025 mol· L-1· min-1 < > 82.4% 2NH3 -6e- +6OH-=N2+6H2O 0.8
【解析】(1)氨气的电子式为![]() 。
。
(2)由题中信息可知,叠氮化钠(NaN3)可与NaClO溶液反应,生成氮气,根据元素的化合价变化规律,该反应的化学方程式为NaClO+2NaN3+ H2O=NaCl +2NaOH +3N2↑。
(3)已知:(i)4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H1=-1266kJ/mol;(ii)H2O(g)=H2O(l) △H2=-44.0kJ/mol。根据盖斯定律,由(i)
2N2(g)+6H2O(g) △H1=-1266kJ/mol;(ii)H2O(g)=H2O(l) △H2=-44.0kJ/mol。根据盖斯定律,由(i)![]() - (ii)
- (ii)![]() 可得2N2(g)+6H2O(l)
可得2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) △H3=+1 530 kJ/mol。
4NH3(g)+3O2(g) △H3=+1 530 kJ/mol。
(4)①由图甲可知, 从反应开始到达平衡,X、Y的变化量分别为0.50 mol/L和0.75 mol/L,变化量之比为2:3,所以,X为NH3、Y为H2,反应达到平衡时的平均反应速率v(N2)=![]() 0.025 mol L-1min-1。
0.025 mol L-1min-1。
②由合成氨的反应可知,在相同温度下,压强越大,氨的体积分数越大;在相同压强下,温度越高氨的体积分数越小,其平衡常数越小。由图乙可知,在300℃下,平衡体系中NH3的体积分数:B点大于C点。所以,压强p1<p2;B、D两点的平衡常数KB>KD;B点氨的体积分数为70%,设氮气的转化率为x,则氢气和氨气的变化量分别为3x和2x,所以,![]() ,解之得x=
,解之得x=![]() ,所以,N2的转化率
,所以,N2的转化率![]() =82.4%。
=82.4%。
(5)由题意可知,氨气在负极上发生氧化反应生成氮气,其电极反应式为2NH3 -6e- +6OH-=N2+6H2O。当有标准状况下4.48LNO2被处理时,即0.2mol NO2被还原,N的化合价由+4降为0,转移电子的物质的量为0.8mol。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】已知某无色透明溶液中仅含有包括Na+和CH3COO﹣在内的四种离子.
请回答下列问题.
(1)该溶液中的溶质可能有三种情况,请分别写出各种情况的化学式:①②; ③ .
(2)25℃,若由0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液的pH=8,则c(CH3COOH)+c(H+)的精确值为mol/L.
(3)若该溶液的pH=8,则c(Na+)﹣c(CH3COO﹣)的精确值为mol/L.
(4)当溶液中各离子浓度大小的顺序为c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣)时,则该溶液可能是(填序号);
A.由0.1mol/L的CH3COONa溶液与0.1mol/L的CH3COOH溶液等体积混合而成
B.由0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合而成
C.由0.2mol/L的CH3COONa溶液与0.1mol/L的HCl溶液等体积混合而成
D.由0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合而成
(5)常温下,将a mol/L的CH3COOH溶液与0.01mol/L的NaOH溶液等体积混合,反应平衡后溶液中c(Na+)=c(CH3COO﹣),用含a的代数式表示CH3COOH的电离平衡常数Ka= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
砷主要以硫化物矿的形式(如雄黄,雌黄等)存在于自然界。砷及其化合物主要用于合金冶炼、农药医药、颜料等工业。请根据有关砷及其化合物的转化关系和晶体结构图,回答下列问题:

(1)量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道,电子除空间运动状态外,还有一种运动状态叫做__________________。
(2)基态砷原子的核外电子排布式为_______________,与砷同周期的p区元素中第一电离能大于砷的元素有_______________ (填元素符号)。
(3)雄黄分子中,As原子的杂化方式为_________________。
(4)雄黄可经过如下三步反应生成雌黄:

①反应Ⅲ的化学方程式为________________________。
②SO2的中心原子的VSEPR构型为______________________。
③亚砷酸属于三元弱酸,酸性:H3AsO3________HNO2(填“>”或“<”),请根据物质结构的知识解释原因:____________________________。
(5)①图3是由Li、Fe和As三种元素组成的超导体化合物的晶体结构(该晶胞是立方晶胞,Li在晶胞内部),该晶体的化学式为_____________________。
②若1号原子的坐标为(0,0,0),2号原子的坐标为(1/4,1/4,1/3),则3号原子的坐标为___________。
③已知该晶胞参数ɑ=0.53nm,阿伏加德罗常数的值为NA,则该晶体的密度为_______g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,用0.0200mol/L稀盐酸滴定20.00mL0.0200mol/LNaY溶液,溶液中水的电离程度随所加稀盐酸的体积变化如图所示(忽略滴定过程中溶液的体积变化),则下列有关说法正确的是
已知:K(HY)=5.0×10-11

A. 可选取酚酞作为滴定指示剂 B. M点溶液的pH>7
C. 图中Q点水的电离程度最小,Kw<10-14 D. M点,c(Na+)=c(HY)+c(Y-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用OH-+H+ =H2O表示的化学方程式有
A.碳酸氢钠溶液与氢氧化钠溶液反应
B.氢氧化铁与稀硫酸反应
C.氢氧化钡溶液与稀硫酸反应
D.氢氧化钡溶液与稀硝酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示.下列说法中正确的是( )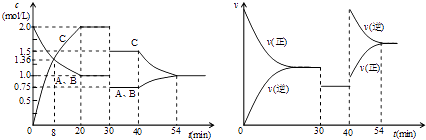
A.30min时降低温度,40min时充入生成物C
B.0~8min内A的平均反应速率为0.08mol/(Lmin)
C.反应方程式中的x=1,正反应为吸热反应
D.20min~40min间该反应的平衡常数均为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2(亚氯酸纳)是常用的消毒剂和漂白剂,工业上可采用电解法制备,工作原理如图所示。下列叙述正确的是
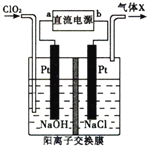
A. 若直流电源为铅蓄电池,则b极为Pb
B. 阳极反应式为ClO2+e-=ClO2-
C. 交换膜左测NaOH的物质的量不变,气体X为Cl2
D. 制备18.1gNaClO2时理论上有0.2molNa+由交换膜左侧向右侧迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢(H2S)的转化是资源利用和环境保护的重要研究课题。
(1)H2S和CO混合加热可制得羰基硫(COS),羰基疏可作粮食熏蒸剂,能防止其些昆虫、线虫和真菌的危害。反应方程式为CO(g)+H2S(g)=COS(g)+H2(g)。
①羰基硫的电子式为__________。
②下列能说明碳与硫两元素非金属性相对强弱的是_______(填字母代号)。
a.相同条件下水溶液的pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.S与H2的化合比C与H2的化合更容易
(2)H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式____________。
(3)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)=______ mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=_______时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]。
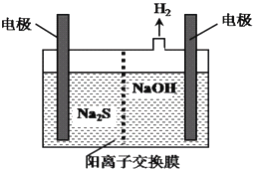
(4)H2S的废气可用烧碱溶液吸收,将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2--2e-=S↓ (n-1)S+S2-![]() Sn2-写出电解时阴极的电极反应式:______________________。
Sn2-写出电解时阴极的电极反应式:______________________。
(5)一定温度下将NH4HS固体放入定容真空密闭容器中,可部分分解为硫化氢和氨气:NH4HS(s)![]() H2S(g)+NH3(g)。
H2S(g)+NH3(g)。
①可以判断上述分解反应已经达到化学平衡状态的是_______ (填字母代号)
A.v(H2S)=v(NH3) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②当上述反应达平衡时:p(NH3)×p(H2S)=a(Pa2),则平衡时容器中的总压为_______Pa( 用含a 的代数式表示).[p(NH3)、p(H2S)分别代表NH3、H2S的压强,Pa为压强的单位]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌钡白是一种白色颜料,工业上由ZnSO4与BaS溶液混合而成,BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。

Ⅰ.ZnSO4溶液的制备与提纯:
有关资料:
a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
(1)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤____(选填①、②、③或⑤)。
(2)若步骤缺少②中加入的氧化剂为H2O2,写出反应的离子方程式_____________。
(3)滤渣2中主要成分为____________________(填化学式)。
(4)写出步骤④后产生滤渣3的反应的离子方程式________________。
(5)滤液3中含碳粒子的浓度大小顺序为_____________。
Ⅱ.BaS溶液的制备

(6)写出“煅烧还原”反应的化学方程式_____________。BaSO4和BaCO3的Ksp数值接近,用平衡原理解释为什么BaCO3可溶于盐酸,而BaSO4难溶:______________。
Ⅲ.制取锌钡白
(7)如果上述工业生产流程中步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌银白产生的后果是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com