
【题目】在25’C时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol/L | 0.1 | 0.2 | 0 |
平衡浓度/mol/L | 0. 05 | 0. 05 | 0.1 |
下列说法错误的是
A. 反应达衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 改变温度可以改变此反应的平衡常数
科目:高中化学 来源: 题型:
【题目】下列各组离子反应可用H++OH-= H2O表示的是( )
A. 氢氧化钡和硫酸 B. 氢氧化铜和盐酸
C. 盐酸和氢氧化钠 D. 硫酸和氢氧化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式不正确的是( )
A.乙醇与浓氢溴酸反应?? CH3CH2OH+HBr ![]() CH3CH2Br+H2O
CH3CH2Br+H2O
B.溴乙烷与氢氧化钠溶液共热?? CH3CH2Br+NaOH ![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
C.苯酚钠中通入少量的二氧化碳?? 2 ![]() +CO2+H2O→2
+CO2+H2O→2 ![]() +Na2CO3
+Na2CO3
D.乙醛催化氧化?? 2CH3CHO+O2 ![]() 2CH3COOH
2CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从樟科植物枝叶中提取的精油含有甲、乙两种成分: 
(1)①乙中非含氧官能团的名称为 . ②甲在一定条件下发生加聚反应,其产物的结构简式是 .
③同时满足下列4个条件的甲的同分异构体的结构简式是 .
a.苯环上有两个不同的取代基,结构中不含甲基
b.能与Br2的CCl4溶液发生加成反应
c.能与NaOH溶液反应
d.苯环上的一氯代物只有两种
(2)由甲转化为乙的过程为(已略去无关产物): ![]()
①反应I的反应类型是 .
②反应II的化学方程式是 .
③反应Ⅲ所需的试剂是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两组物质:①CO2、P2O5、CaO、SO2,②O2、Mg、Zn、Al。每组中有一种物质在某些化学性质或分类上与其他几种物质不同,这两种物质是①_______________,②_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,不同氢原子的核磁共振谱中给出的信号也不同,根据信号可以确定有机物分子中氢原子的种类和数目.例如二乙醚的结构简式为:CH3﹣CH2﹣O﹣CH2﹣CH3 , 其核磁共振谱中给出的信号有两个,如图①所示: 
(1)下列物质中,其核磁共振氢谱中给出的信号只有一个的是 . (填序号)
A.CH3CH3
B.CH3COOH
C.CH3COOCH3
D.CH3OCH3
(2)化合物A和B的分子式都是C2H4Br2 , A的核磁共振氢谱图如右图②所示,则A的结构简式为 , 请预测B的核磁共振氢谱上有种信号.
(3)在常温下测得的某烃C8H10(不能与溴水反应)的核磁共振谱上,观察到两种类型的H原子给出的信号,其强度之比为2:3,试确定该烃的结构简式为;该烃在光照下生成的一氯代物在核磁共振谱中可产生种信号,强度比为 .
(4)在常温下测定相对分子质量为128的某链烃的核磁共振谱,观察到两种类型的H原子给出的信号,其强度之比为9:1,则该烃的结构简式为 , 其名称为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池作电源电解某溶液100mL.已知该溶液中含SO2、KI,其物质的量浓度均为0.1mol/L,如图所示(C1、C2为石墨电极),下列说法正确的是( ) 
A.铅蓄电池工作一段时间后A溶液的pH变小
B.当B烧杯中I﹣的浓度降为0.05mol/L时,消耗A中的H2SO4的物质的量为0.025mol
C.当C1、C2两极均产生气体时,应有至少3.6×1022个电子从电路中流过
D.铅蓄电池工作时负极电极反应式为:PbO2﹣2e﹣+H2SO4═PbSO4+2H2O+SO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲及其化合物具有许多优良性能,被广泛用于冶金、化工、医药卫生等工业领域.铜阳极泥(主要成分除含Cu、Te外,还有少量Ag和Au)经如下工艺流程如图1得到粗碲.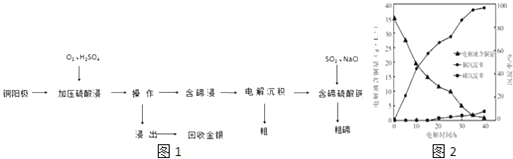
(1)“加压硫酸浸出”过程中会发生以下化学反应:Cu2Te+2O2=2CuO+TeO2;TeO2+H2SO4=TeOSO4+H2O
①Ag2Te也能与O2发生类似Cu2Te的反应,化学方程式为 .
②工业上给原料气加压的方法是 .
(2)操作Ⅰ是 .
(3)“含碲浸出液”的溶质成分除了TeOSO4外,主要是(填化学式).
(4)“电解沉积除铜”时,将“含碲浸出液”置于电解槽中,铜、碲沉淀的关系如图2.电解初始阶段阴极的电极反应式是 .
(5)向“含碲硫酸铜母液”通入SO2并加入NaCl反应一段时间后,Te(IV)浓度从6.72gL﹣1下降到0.10gL﹣1 , Cu2+浓度从7.78gL﹣1下降到1.10gL﹣1 . ①TeOSO4生成Te的化学方程式为 .
②研究表明,KI可与NaCl起相同作用,从工业生产的角度出发选择NaCl最主要的原因是
③计算可得Cu2+的还原率为85.9%,Te(IV)的还原率为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com