
(12分)W、X、Y、Z均为短周期主族元素,W的最外层电子数与核外电子总数之比为3∶8;X的核外电子总数与Y的最外层电子数相等,X的原子序数是Z的原子序数的一半;W、Y、Z位于同一周期。
(1)写出X的氢化物的电子式 Z单质的晶体类型是 类型
(2)W、Y、Z三种元素的气态氢化物稳定性由高到低的顺序是 。(用化学式表示,Z的气态氢化物与其同主族元素气态氢化物化学式写法相似)。
(3)已知A、B、C、D四种物质存在如下反应关系:A+B―→C+D
①若A是Y和Z常见价态的化合物,B是X的氢化物,D是Y的氢化物,反应过程中没有化合价变化,该反应的化学方程式是 。
②若A是Z的单质,B为红色固体,D为紫红色固体单质,高温下发生该反应,C的化学式是__________。D与X元素最高价氧化物对应水化物的浓溶液反应,生成的气体会对大气造成污染。用烧碱溶液吸收该气体生成两种盐,其中一种盐可用作防腐剂,烧碱溶液吸收气体的离子方程式是_______ ___________。
(12分)(1)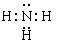 (2分) 原子晶体(2分) (2)HCl>H2S>SiH4 (2分)
(2分) 原子晶体(2分) (2)HCl>H2S>SiH4 (2分)
(3)①3SiCl4+4NH3=Si3N4+12HCl (2分)
②SiO2(2分)2NO2+2OH-===NO2—+NO3—+H2O(2分)
解析试题分析:W的最外层电子数与核外电子总数之比为3∶8,所以W应该是S元素。X的原子序数是Z的原子序数的一半,X的核外电子总数与Y的最外层电子数相等,且Y、Z位于第三周期,所以Y是氯元素,则X就是氮元素,所以Z应该是硅元素。
(1)氮元素的氢化物是氨气,含有极性键的共价化合物,电子式是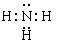 。硅单质形成的晶体是原子晶体,和金刚石结构类似。
。硅单质形成的晶体是原子晶体,和金刚石结构类似。
(2)非金属性越强,氢化物的稳定性越强,所以W、Y、Z三种元素的气态氢化物稳定性由高到低的顺序是)HCl>H2S>SiH4。
(3)①若A是Y和Z常见价态的化合物,则A是四氯化硅。B是X的氢化物,即位氨气。D是Y的氢化物,则D是氯化氢。又因为反应过程中没有化合价变化,该反应的化学方程式是SiCl4+4NH3=Si3N4+12HCl。
②若A是Z的单质,B为红色固体,D为紫红色固体单质,所以D是铜,则B是氧化亚铜。所以根据原子守恒可知,C的化学式是SiO2。X元素最高价氧化物对应水化物是硝酸,所以反应中生成的气体是NO2。NO2和氢氧化钠溶液反应生成亚硝酸钠和硝酸钠,其中亚硝酸钠可以作为防腐剂,方程式是2NO2+2OH-===NO+NO+H2O。
考点:考查元素周期表的结构、元素周期律的应用及电子式和方程式的书写等
点评:该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力,综合性较强。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属性:Y<Z | B、氢化物的沸点:X>W | C、离子的还原性:X<W | D、原子及离子半径:Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com