
X、Y均为短周期元素,二者可组成化合物X2Y3。若已知Y的原子序数m,则X的原子序数不可能是( )
A.m+5 B. m-11 C. m+6 D. m-3
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
下表是元素周期表的一部分,根据表中10种元素,用元素符号或化学式填空。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑨ | ⑧ | ⑩ |
(1)①~⑩元素中,金属性最强的是 ;化学性质最不活泼的是 。
(2)①~⑩元素中,最高价氧化物水化物呈两性的是 ,该化合物与NaOH溶液反应的离子方程式为 ;
(3)①~⑩元素中,最高价氧化物水化物酸性最强的是 ,碱性最强的是 ;
(4)⑤、⑥、⑧、⑨所形成的离子,其半径由小到大的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。关于标有“+”的接线柱,下列说法中正确的是 ( )
A.充电时作阳极,放电时作负极 B.充电时作阳极,放电时作正极
C.充电时作阴极,放电时作负极 D.充电时作阴极,放电时作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)  2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)写出该反应的化学平衡常数表达式K=__________。
 (2)降低温度,该反应K值______,二氧化硫转化率______,化学反应速率______。(以上均填“增大”“减小”或“不变”)
(2)降低温度,该反应K值______,二氧化硫转化率______,化学反应速率______。(以上均填“增大”“减小”或“不变”)
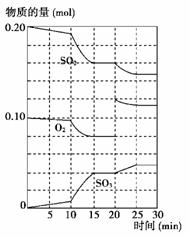
(3)600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是________。
(4)据上图判断,反应进行至20 min时,曲线发生变化的原因是________________ __________________________(用文字表达);10 min到15 min的曲线变化的原因可能是________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
能够用化学键强度大小解释的是( )
A.氮气的化学性质比氧气稳定 B.氨气极易溶解于水
C.稀有气体一般很难发生化学反应 D.硝酸易挥发,而硫酸难挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语使用正确的是( )
A.质子数为6的原子:12C
 B.Al(OH)3的电离方程式:H++AlO
B.Al(OH)3的电离方程式:H++AlO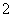 +H2O
+H2O Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-
C.CH4Si的结构式:
 |
D.次氯酸的电子式:
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下往100mLFeCl3溶液中通入0.224L标况下的H2S,结果生成单质硫。再加入过量铁粉,反应停止后溶液中含有0.06mol阳离子。原FeCl3溶液的浓度是( )
A.0.1mol/L B.0.2mol/L C.0.3mol/L D.0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学——选修2化学与技术】
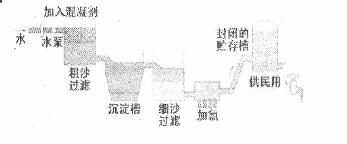 生产自来水的流程图所示。
生产自来水的流程图所示。
(1) FeSO4·7H2O是常用的混凝剂,它在水中最终生成 沉淀。
(2)实验室过滤操作所用到的玻璃仪器是 。
(3)我们有时感觉自来水“有漂白粉的气味”,是因为使用了氯气消毒,请写出有关化学方程下列物质中, (填写序号)可以作为氯气的代用品。
①臭氧 ②NH3(溶液) ③K2FeO4 ④SO2
(4)有些地区的天然水中含有较多的钙、镁离子。用离子交换树脂软化硬水时,先后把水通过分别装有 离子交换树脂和 离子交换树脂的离子交换柱(填“阴”或 “阳”)。
(5)测定水中的溶解氧:量取20mL水样,迅速加入MnSO4和KOH的混合溶液,再加入KI溶液,立即塞好塞子,振荡使其完全反应。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。用0.10mol/L Na2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液。已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+。
上述过程发生的反应可表示为:
2Mn2++4OH-+O2=2MnO(OH)2
MnO(OH)2+2I-+4H+=I2+Mn2++3H2O
I2+2S2O32-=2I-+S4O62-
水中的溶解氧量为 (以mg·L-l为单位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活密切相关,下列说法不正确的是( )
A、用碘酒滴加在阿斯匹林、去痛片等药片上,可检验药片是否含有淀粉。
B、皮肤、指甲上不慎沾上浓硝酸会出现黄色
C、广告称某品牌的八宝粥(含桂圆、红豆、糯米等)不加糖,比加糖还甜,适合糖尿病人食用
D、炒菜时,加一点酒和醋能使菜味可口,原因是有酯类物质生成。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com