
| A. | 2.0 L 1.0 mol•L-1CH3COOH溶液中的H+数 | |
| B. | 2.0 L 1.0 mol•L-1 CH3COONa溶液中的CH3COO-数 | |
| C. | 1.0 L 1.0 mol•L-1 NaHCO3 溶液中的HCO3-数 | |
| D. | 1.0 L 1.0 mol•L-1 Na2CO3溶液中的CO32-数 |
分析 阿伏伽德罗常数为6.02×1023/mol,即NA个.
A、求出醋酸的物质的量n=CV,然后根据醋酸是弱酸来分析;
B、求出醋酸钠的物质的量n=CV,然后根据醋酸根是弱酸根,在溶液中会水解但水解程度很小来分析;
C、求出碳酸氢钠的物质的量n=CV,然后根据HCO3-的水解和电离程度均很小来分析.
D、求出碳酸钠的物质的量n=CV,然后根据CO32-的水解程度相对较大来分析.
解答 解:阿伏伽德罗常数为6.02×1023/mol,即NA个.
A、溶液中醋酸的物质的量n=CV=1mol/L×2L=2mol,而醋酸是弱酸,电离程度很小,故溶液中的氢离子的个数远小于NA个;
B、醋酸钠的物质的量n=CV=mol/L×2L=2mol,而醋酸根是弱酸根,在溶液中会水解但水解程度很小,故溶液中的醋酸根的个数小于但很接近于2NA个;
C、碳酸氢钠的物质的量n=CV=1mol/L×1L=1mol,而HCO3-的水解和电离程度均很小,故HCO3-个数虽小于但很接近于NA个;
D、碳酸钠的物质的量n=CV=1mol/L×1L=1mol,而CO32-的水解程度较HCO3-大,故CO32-的个数小于NA个.
综合比较分析可知,最接近阿伏加德罗常数的值的是C.
故选C.
点评 本题依托阿伏伽德罗常数,考查了弱电解质的电离和盐类的水解,应注意的是越弱越水解,故CO32-的水解程度较HCO3-大.


科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn和Cu | B. | Fe和Zn | C. | Al和Fe | D. | Fe和Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核中含有92个中子 | B. | 原子核外有143个电子 | ||
| C. | 与${\;}_{92}^{238}U$互为同位素 | D. | 与${\;}_{92}^{238}U$为同一核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三聚氰胺的摩尔质量为126g/mol | |
| B. | 三聚氰胺中C、N、H的原子个数比为1:2:2 | |
| C. | 三聚氰胺中C、N两种元素的质量比为6:7 | |
| D. | 三聚氰胺中氮元素的质量分数约为66.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
. 或
或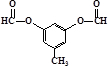 .
. 与G互为同分异构体
与G互为同分异构体查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| n(CO2)(mol) | 1 | 2 | 4 | 5 |
| n(沉淀)(mol) | 0 | 1 | 3 | 3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| H2(g) | Br2(g) | HBr(g) | |
| 1 mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入KSCN显血红色的溶液:Na+、NH4+、Cl-、I- | |
| B. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 0.1 mol•L-1的NaOH溶液:K+、SiO32-、NO3-、SO42- | |
| D. | 通入足量SO2后的溶液:Na+、NH4+、ClO-、CH3COO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com