
| A、0.1mol/L稀盐酸中,Cl-数为0.1NA |
| B、2.24 L NH3中含N-H键数目为0.3NA |
| C、2.8g N2和2.8g CO所含分子数均为0.1NA |
| D、0.lmol H2O2完全分解转移的电子数为0.2NA |


 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
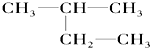 ③金刚石④
③金刚石④35 17 |
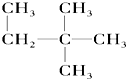 ⑥
⑥ ⑦
⑦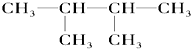 ⑧氯气 ⑨石墨 ⑩
⑧氯气 ⑨石墨 ⑩37 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 投料比[n(H2)/n(CO2)] | 500K | 600K | 700K | 800K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 性质 |
| A | 一种核素的原子核内不含中子 |
| B | 原子核外电子有6种不同运动状态 |
| C | 最高价氧化物的水化物与其氢化物可发生非氧化还原反应 |
| D | 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
| E | 在地壳中的含量位居第三 |
| F | 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
| G | 该元素的一种氧化物M可用作油漆颜料,与E的单质反应可应用于焊接钢轨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B、1 mol Na202固体中含离子总数为4NA |
| C、标准状况下,11.2L苯中含有分子的数目为0.5NA |
| D、在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 方案 | 反应物 |
| 甲 | Cu、浓硝酸 |
| 乙 | Cu、稀硝酸 |
| 丙 | Cu、O2、稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度 |
| B、加入适量的水 |
| C、加入少量CuSO4溶液 |
| D、加入浓度较大的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸钠的水解反应:CH3COO-+H3O+?CH3COOH+H2O |
| B、稀H2SO4与足量Ba(OH)2溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| C、Fe(OH)3沉淀中加入足量HI:Fe(OH)3+3H+=Fe3++3H2O |
| D、AlCl3溶液中与过量氨水混合:Al3++3NH3?H2O=3NH4++Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
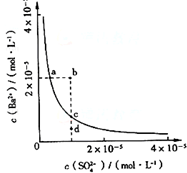
| A、加入Na2SO4可以使溶液由a点变到b点 |
| B、通过蒸发可以使溶液由d点变到c点 |
| C、a、b、c、d点溶液中Kw相等 |
| D、a点对应的Ksp大于c点对应的Ksp |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com