
【题目】冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)使用甲醇汽油可以减少汽车尾气对环境的污染。工业上在200℃和10MPa的条件下可用甲烷和氧气通过铜制管道反应制得甲醇,已知一定条件下,CH4和CH3OH的燃烧热分别784kJ/mol和628kJ/mol ,则CH4(g) +![]() O2(g) = CH3OH(g) △H=___。
O2(g) = CH3OH(g) △H=___。
(2)二甲醚也是清洁能源。用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g) + 4H2(g) ![]() CH3OCH3(g) + H2O(g) △H<0。
CH3OCH3(g) + H2O(g) △H<0。
①.某温度下,将2.0molCO(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中 CH3OCH3(g) 的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是___。
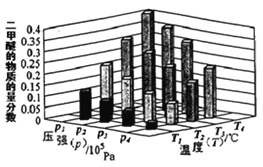
A. P1>P3, T1>T3 B. P3>P2,T3>T2 C.P2>P4,T4>T2 D.P1>P4,T2>T3
②在恒容密闭容器里按体积比为1:3充入一氧化碳和氢 气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是___
A.氢气的转化率减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.某反应物的体积百分含量增大
(3)在一容积可变的密闭容器中充有10 mol CO和20 mol H2, 发生反应CO(g)+2H2(g) ![]() CH3OH(g),CO的平衡转化率[与温度(T)、压强(p)的关系如图所示。
CH3OH(g),CO的平衡转化率[与温度(T)、压强(p)的关系如图所示。

①A、B、C三点对应的平衡常数KA、KB、KC的大小关系为______。
②若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为________L。
【答案】-156kJ/mol AD B KA=KB>KC 2
【解析】
(1)根据盖斯定律进行分析;
(2)①.由反应方程式知,增大压强,平衡正向移动,则P1>P2>P3>P4;由方程式知,升高温度,平衡逆向移动,则T1>T2>T3>T4。
②根据影响化学平衡移动的外界因素及平衡移动原理、化学平衡状态的特征进行分析;
(3)①根据温度对化学平衡常数的影响进行分析。
② 根据两点温度相同则平衡常数相同进行计算。
(1)CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-784kJ/mol ①
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) △H=-628kJ/mol ②
O2(g)=CO2(g)+2H2O(l) △H=-628kJ/mol ②
①-②得:CH4(g) +![]() O2(g) = CH3OH(g) △H=-156kJ/mol。答案为:-156kJ/mol;
O2(g) = CH3OH(g) △H=-156kJ/mol。答案为:-156kJ/mol;
(2)①.由反应方程式2CO(g) + 4H2(g) ![]() CH3OCH3(g) + H2O(g) △H<0可知,增大压强,平衡正向移动,则P1>P2>P3>P4;由方程式知,升高温度,平衡逆向移动,则T1>T2>T3>T4。答案为:AD;
CH3OCH3(g) + H2O(g) △H<0可知,增大压强,平衡正向移动,则P1>P2>P3>P4;由方程式知,升高温度,平衡逆向移动,则T1>T2>T3>T4。答案为:AD;
②2CO(g) + 4H2(g) ![]() CH3OCH3(g) + H2O(g) △H<0
CH3OCH3(g) + H2O(g) △H<0
A.从反应方程式可以看出,若往平衡体系中充入H2,平衡正向移动,但氢气的转化率减小,A不合题意;
B.逆反应速率先增大后减小,则可能是升高温度或往平衡体系中充入CH3OCH3或H2O(g),平衡逆向移动,B符合题意;
C.化学平衡常数K值增大,只能为降低温度,平衡正向移动,C不合题意;
D.某反应物的体积百分含量增大,可能是往平衡体系中加入该反应物,则平衡正向移动,D不合题意。答案为:B;
(3)①从图中可以看出,升高温度,CO的转化率减小,则平衡逆向移动,△H<0。在A、B点,温度相同,对应的平衡常数KA=KB;A、C点,T1<T2,对应的平衡常数KA>KC,从而得出A、B、C三点对应的平衡常数KA、KB、KC的大小关系为KA=KB>KC。
② 在A点,容器体积为10L:

K=![]() ;
;
在B点,设气体的体积为V:
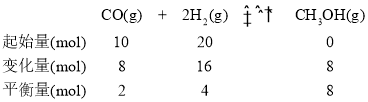
A和B两点的温度相同,则平衡常数相同,故K=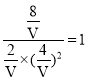 ,解之得,V=2L。答案为:2。
,解之得,V=2L。答案为:2。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶性杂质)回收铜和铬等金属,回收流程如图所示:

已知部分物质沉淀的pH(如表)及CaSO4元的溶解度曲线(如图):
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀 | 2.1 | 4.7 | 4.3 |
完全沉淀 | 3.2 | 6.7 | 5.6 |

(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有_____________(填化学式)。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到______;
②将浊液加热到80℃,____________。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子方程式:_________,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比是重要的学习方法,类比pH的定义可定义pOH和pKW。在某弱酸HX及其盐NaX的混合溶液中(HX和NaX的含量不确定),c(H+)和c(OH-)存在如图所示的关系,则下列说法不正确的是
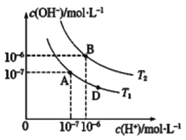
A. 图中温度T2>25℃
B. 若此混合溶液呈酸性且c(HX)=c(NaX),则HX电离能力大于NaX的水解能力
C. 位于AB线段上任意点的溶液均有pH=pOH=![]()
D. 图中D点处溶液中离子浓度:c(Na+)>c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是![]() 溶液中各离子浓度的相对大小关系示意图:
溶液中各离子浓度的相对大小关系示意图:
(1)其中,![]() 是 ______。
是 ______。![]() 填微粒符号
填微粒符号![]()
(2)在![]() 溶液中各微粒浓度等式关系正确的是_______
溶液中各微粒浓度等式关系正确的是_______
a. ![]()
b. ![]()
c. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请写出下列物质的电子式:
(1)H2S________; (2)CO2________; (3)N2________;
(4)OH-________; (5)HClO________;(5)Na2O2________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄钾铁矾渣经如下流程可将其转化为锰锌铁氧体:

已知:①黄钾铁矾渣中铁主要以Fe2O3形式存在,锌主要以硫酸锌(ZnSO4)、氧化锌(ZnO)、硅酸锌(ZnSiO3)形式存在,黄钾铁矾渣的某些元素成分如下表所示:
元素 | Fe | Zn | Cu | Cd | Ca | Mg | Si |
质量分数 | 28.9 | 8.77 | 0.37 | 0.18 | 0.37 | 0.84 | 4.63 |
②NH4F溶液用于沉淀Mg2+和Ca2+,②Fe和Cd的金属活动性相近
⑴“酸浸”后,滤渣1的主要成分为________(写化学式);为了提高浸出率,可采取的措施有________(写出一种即可)。
⑵“还原除杂”工序中,加入铁粉是为了除去溶液中________、________等金属杂质离子。
⑶加入(NH4)2S沉淀Cd2+时应避免过量,原因是________;若此过程中溶液搅拌时间过长,则会导致Cd2+去除率偏低,原因是________。(已知:CdS的溶度积Ksp = 8×10-27,FeS的溶度积Ksp = 4×10-19,ZnS的溶度积Ksp = 1.6×10-24)
⑷写出“共沉淀”工序中生成FeCO3的离子反应方程式为:________。
⑸锰锌铁氧体是一种重要的磁性材料。测定铁氧体中ZnO的实验步骤如下:

①写出除锰(Mn2+)步骤中的离子方程式________。
②准确量取25.00 mL溶液A,掩蔽铁后,用二甲酚橙作指示剂,用0.0100mol/L的EDTA(Na2H2Y)标准溶液滴定其中的Zn2+ (反应原理为Zn2+ + H2Y2- =ZnY 2- + 2H+),至滴定终点时消耗EDTA标准溶液20.00 mL。通过计算确定该铁氧体中ZnO的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.可用明矾和漂白粉处理自来水,二者的作用原理相同
B.室温下向10mLpH=3的醋酸溶液中加水稀释后,溶液中![]() 不变
不变
C.氯水、氨水、王水是混合物,水银、水玻璃是纯净物
D.可用澄清的石灰水鉴别碳酸钠和碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下:
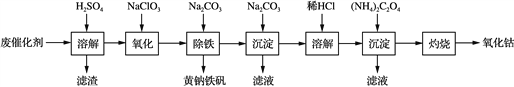
(1) 溶解:溶解后过滤,将滤渣洗涤2~3次,再将洗液与滤液合并的目的是________________________________________________________________________。
(2) 氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式是____________________________。
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]·3H2O。
3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-===Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是__________________________________。(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3) 除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式:_____________________________________________________。
(4) 沉淀:生成沉淀碱式碳酸钴[(CoCO3)2·3Co(OH)2],沉淀需洗涤,洗涤的操作是________________________________________________________________________。
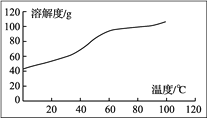
(5) 溶解:CoCl2的溶解度曲线如图所示。向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是__________________________________________。
(6) 灼烧:准确称取CoC2O4 1.470 g,在空气中充分灼烧得0.830 g氧化钴,写出氧化钴的化学式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近一个科学硏究小组创建了一种通过连续电解将能量储存为化学能的装置。在氧化钇基质的阳极和二氧化钛涂覆的钛阴极之间是可通过H+的固体聚合物电解质。其结构如图所示,则下列说法正确的是
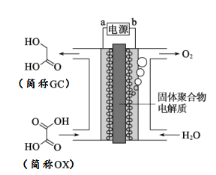
A. 电源的b极为负极
B. 在能量转换过程中,固体电解质中H+由阴极向阳极移动
C. 阴极电极反应式为:OX + 4H+ + 4e﹣═ GC + H2O
D. 为增强阳极电解液导电性,可在水中添加适量NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com