

分析 (1)氯气中混有HCl,先通过饱和食盐水除去HCl,然后与消石灰反应生成漂白粉,最后用氢氧化钠吸收尾气;
(2)氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水;
(3)Ⅰ.氯化氢酸性强于次氯酸,氯化氢能够与次氯酸钙反应生成次氯酸和氯化钙;
Ⅱ.因为温度高时易生成Ca(ClO3)2,所以避免此反应发生可以采取降温措施.
解答 解:(1)实验室用浓盐酸与二氧化锰加热制备氯气,氯气中含有氯化氢和水蒸气,所以从发生装置出来的气体先通过饱和食盐水除去氯化氢,利用氯气与潮湿的消石灰反应制取少量漂白粉,所以不需要干燥氯气,通过氢氧化钙反应生成次氯酸钙,最后用氢氧化钠吸收过量的氯气,正确的顺序为:agfedhi;
故答案为:agfedhi;
(2)氯气通入石灰乳[Ca(OH)2]制取漂白粉,反应生成CaCl2、Ca(ClO)2、H2O,该反应为Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,
故答案为:Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;
(3)Ⅰ.氯化氢能够与次氯酸钙反应生成次氯酸和氯化钙,方程式:2HCl+Ca(ClO)2=CaCl2+HClO;
故答案为:2HCl+Ca(ClO)2=CaCl2+HClO;
Ⅱ.温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,用冰水或冷水冷却,
故答案为:将U型管置于冷水浴中.
点评 本题考查了实验室制漂白粉的装置分析和制备条件判断,明确氯气的制备原理及性质是解题关键,注意信息中温度不同产物不同,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 石油分馏是物理变化,可得到汽油、煤油和柴油等产品 | |
| B. | 石油的催化重整和煤的干馏均可以得到芳香烃 | |
| C. | 石油裂解的目的主要是为了得到更多的汽油 | |
| D. | 煤、石油、天然气既是一次能源,又是不可再生能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 235U中的235表示该原子的相对原子质量 | |
| B. | HClO的结构式:H-Cl-O | |
| C. | 丙烷分子的比例模型: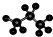 | |
| D. | 第三周期简单阴离子结构示意图均可表示为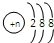 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH=CH-CHO | B. | CH3-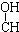 - -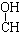 -CH3 -CH3 | ||
| C. | HOCH2-CH2-CH=CH-CHO | D. | HOCH2-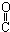 -CH2-CHO -CH2-CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验设计 |
| A | 制备Fe(OH)3胶体 | 向0.1mol•L-1的FeCl3溶液中加入等体积0.3mol•L-1的NaOH溶液,煮沸 |
| B | 除去CO2中的HCl | 将混合气体依次通入Na2CO3溶液和浓硫酸中 |
| C | 检验溶液中是否含有SO42- | 取少量待检测溶液,向其中加入Ba(NO3)2溶液,再加入少量盐酸,观察实验现象 |
| D | 验证氧化性:Fe3+<Br2<Cl2 | 向试管中依次加入1mL0.1mol•L-1FeBr2溶液,几滴KSCN溶液和1mL苯,然后逐滴加入氯水,轻轻振荡,观察整个过程中有机相和水相中的现象 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
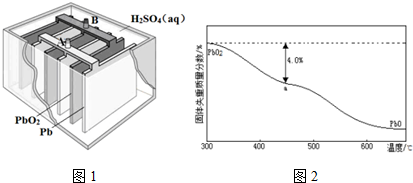
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
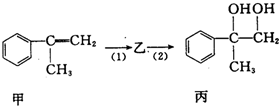
| A. | 反应(1)的无机试剂是液溴,铁作催化剂 | |
| B. | 步骤(2)产物中可能含有未反应的甲,可用酸性高锰酸钾溶液检验是否含甲 | |
| C. | 乙既能发生水解反应,又能发生消去反应 | |
| D. | 反应(1)和(2)均为取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com