
 运用化学原理知识研究化学对于人类的生产生活、科研意义重大.
运用化学原理知识研究化学对于人类的生产生活、科研意义重大.分析 (1)CuFeS2中Cu、Fe的化合价为+2价,S为-2价;利用炉渣制取铁红,可加入氢氧化钠溶液除去SiO2,Al2O3,然后灼烧可得铁红;
(2)溶液中存在氢氧化镁的溶解平衡,电离出的氢氧根离子可与铵根离子结合生成一水合氨,平衡右移;
(3)电解CuCl2溶液一段时间,阳极产生2.24L(标准状况)黄绿色气体,发生2Cl--2e-=Cl2↑,且n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,阴极析出红色物质,生成铜,电极方程式为Cu2++2e-=Cu;
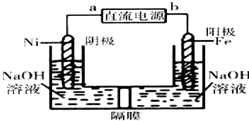
(4)利用电解法制备Na2FeO4,Fe作阳极,碱性条件下Fe失电子转化为FeO42-离子,阳极电极反应式为:Fe+8OH--6e-=FeO42-+4H2O,Ni为阴极,发生还原反应,氢离子放电生成氢气,阴极电极反应式为:6H2O+6e-=3H2↑+6OH-,FeO42-离子氧化性很强,容易在阴极被还原,需要用用阳离子交换膜,防止生成的FeO42-离子在阴极被还原;根据电子转移守恒,计算生成氢气的物质的量,再根据V=nVm计算氢气体积.
解答 解:(1)CuFeS2中Cu、Fe的化合价为+2价,S为-2价,
利用炉渣制取铁红,可加入氢氧化钠溶液除去SiO2,Al2O3,然后灼烧可得铁红,需要的操作为溶解、过滤、灼烧,不需要蒸发结晶,
故答案为:+2;C;
(2)溶液中存在氢氧化镁的溶解平衡Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),电离出的氢氧根离子可与氯化铵电离出的铵根离子结合生成一水合氨,平衡右移,促进Mg(OH)2的溶解,
故答案为:溶液中存在Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),加入氯化铵溶液浸泡时,发生NH4++OH-=NH3•H2O,平衡右移,促进Mg(OH)2的溶解;
(3)电解CuCl2溶液一段时间,阳极产生2.24L(标准状况)黄绿色气体,发生2Cl--2e-=Cl2↑,且n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,转移0.2mol电子,
阴极析出红色物质,生成铜,电极方程式为Cu2++2e-=Cu,则阴极析出0.1molCu,质量为m(CuCl2)=0.1mol×135.5g/mol=13.5g,则若要使电解质溶液恢复至原浓度,应向电解后的溶液中加入13.5gCuCl2,
故答案为:0.2;13.5gCuCl2;
(4)利用电解法制备Na2FeO4,Fe作阳极,碱性条件下Fe失电子转化为FeO42-离子,阳极电极反应式为:Fe+8OH--6e-=FeO42-+4H2O,Ni为阴极,发生还原反应,氢离子放电生成氢气,阴极电极反应式为:6H2O+6e-=3H2↑+6OH-,所以电池反应式为:Fe+2OH-+2H2O $\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑;
根据电子转移守恒,生成氢气的物质的量为$\frac{0.6mol}{2}$=0.3mol,标况下氢气体积为0.3mol×22.4L/mol=6.72L;
故答案为:Fe+2OH-+2H2O $\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑;6.72L.
点评 本题考查较为综合,为高考常见题型,侧重于学生分析能力和计算能力的考查,题目涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写,注意化合价的变化.


科目:高中化学 来源: 题型:选择题
| A. | 铜的金属活动性比铁的弱,铜不能与任何强酸发生反应 | |
| B. | 浓硫酸可用作干燥剂是因为其具有强氧化性 | |
| C. | 利用Al2O3制作的坩埚,可用于熔融烧碱 | |
| D. | 制水泥和玻璃都用石灰石作原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
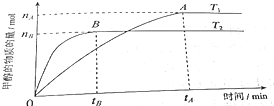
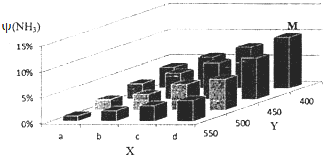 合成氨的工业化生产,解决了世界粮食问题,是重大的化学研究成果.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用N2(g)+3H2(g)?2NH3(g)△H<0反应模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.
合成氨的工业化生产,解决了世界粮食问题,是重大的化学研究成果.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用N2(g)+3H2(g)?2NH3(g)△H<0反应模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、X、Y、Z是前四周期的常见元素,原子序数依次增大,A可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/mol,I4=11575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34,请回答:
A、B、X、Y、Z是前四周期的常见元素,原子序数依次增大,A可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/mol,I4=11575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液:Ag+、Al3+、Cl-、SO42- | |
| B. | 能使酚酞试液变红的溶液:Na+、K+、HCO3-、S2- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10-12的溶液:NH4+、Cu2+、NO3-、Cl- | |
| D. | 水电离产生的c(OH-)=10-12 mol•L-1的溶液:K+、Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2C2O4溶液:c(OH-)═c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)═2c(CO32-)+c(OH-) | |
| D. | CH3COONa和CaCl2溶液:c(Na+)+c(Ca2+)═c(CH3COO-)+c(OH-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com