
| A、14g乙烯和丙烯的混合物中总原子数为3 NA |
| B、常温下11.2L甲烷气体含有甲烷分子数为0.5 NA |
| C、5.6g铁与足量的稀硫酸反应失去电子数为0.3 NA |
| D、0.1mol?L-1的氢氧化钠溶液中含钠离子数为0.1 NA |


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
 国家“十二五规划”明确提出了节能减排的目标,“节能减排”的含义就是节约能源、降低能源消耗、减少污染物排放.合成氨反应放出的热量可用于供暖和发电,是节能的有效措施之一.请你结合学过的知识回答下列问题:
国家“十二五规划”明确提出了节能减排的目标,“节能减排”的含义就是节约能源、降低能源消耗、减少污染物排放.合成氨反应放出的热量可用于供暖和发电,是节能的有效措施之一.请你结合学过的知识回答下列问题:| 时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | 0.20 | 0.80 | 0.20 | a |
| 7 | 0.20 | 0.80 | 0.20 | a |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有较多Ag+溶液:HCO3-、K+、Na+、Cl- |
| B、无色溶液:SO42-、Cl-、K-、Na+ |
| C、能使石蕊试纸变红色的溶液:K+、Fe2+、NO3-、Na+ |
| D、含有较多的Al3+的溶液:Na+、SO42-、I-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色溶液中:H+、Na+、I-、ClO- | ||||||
B、FeCl3溶液:K+、Na+、SO
| ||||||
C、pH=1的溶液中:K+、Fe2+、NO
| ||||||
D、常温条件下,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
A、苯酚钠溶液中通入二氧化碳:2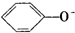 +CO2+H2O→CO32-+2 +CO2+H2O→CO32-+2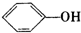 |
| B、醋酸溶液中加入氢氧化钠溶液:H++OH-═H2O |
| C、向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O |
| D、碳酸氢钠溶液呈碱性:HCO3-+H2O?CO32-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+、K+、SO42─、Cl─ |
| B、Ca2+、Mg2+、HCO3─、NO3─ |
| C、Al3+、Na+、SO42─、NO3─ |
| D、K+、Na+、SiO32─、AlO2─ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硝酸铝溶液中加入过量氨水:Al3++4NH3?H2O=[Al(OH)4]-+4NH
| ||
| B、FeI2溶液滴入过量溴水:2Fe2++Br2=2Fe3++4Br- | ||
C、相同体积、相同物质的量浓度的NaHSO4溶液与Ba(OH)2溶液混合:2H++2OH-+Ba2++SO
| ||
| D、向ZnS沉淀上滴加CuSO4溶液,白色沉淀变黑色:ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向AgCl 浊液中加入 KBr 溶液,沉淀变成淡黄色,则 Ksp(AgCl)<Ksp(AgBr) |
| B、NH4HCO3的分解反应能自发进行因为熵变△S>0来解释 |
| C、丁达尔效应是区别胶体与溶液的一种常用物理方法 |
| D、人体内淀粉、脂肪、蛋白质的水解都是由酶所催化的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com