

| A. | 可用溴水区分化合物Ⅱ和化合物Ⅲ | |
| B. | 化合物Ⅰ中所有原子可能在同一平面 | |
| C. | 化合物Ⅰ、Ⅱ、Ⅲ均能与NaHCO3溶液发生反应 | |
| D. | 1 mol化合物Ⅰ最多能与3 mol H2发生加成反应 |
分析 A.II中含有碳碳双键,能和溴发生加成反应;III中不含碳碳双键,和溴不反应;
B.化合物Ⅰ含有饱和碳原子,具有甲烷的结构特点;
C.羧基都能和碳酸氢钠反应;
D.I中苯环和醛基都能和氢气发生加成反应.
解答 解:A.II中含有碳碳双键,能和溴发生加成反应而使溴水褪色;III中不含碳碳双键,和溴不反应,所以不能使溴水褪色,故A正确;
B.化合物Ⅰ含有饱和碳原子,具有甲烷的结构特点,则所有原子不可能在同一平面,故B错误;
C.羧基都能和碳酸氢钠反应,I中不含羧基,所以不能和碳酸氢钠反应,故C错误;
D.I中苯环和醛基都能和氢气发生加成反应,I中含有一个苯环和一个醛基,1molI能和4mol氢气发生加成反应,故D错误,
故选A.
点评 本题考查物质结构和性质,为高考高频点,侧重学生的分析能力的考查,明确物质中官能团及其性质是解本题关键,熟悉常见官能团及其性质,难度不大.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | υ(D)=0.40 mol•L-1•s-1 | B. | υ(C)=0.50 mol•L-1•s-1 | ||
| C. | υ(A)=0.30 mol•L-1•s-1 | D. | υ(B)=0.60 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| B. | 元素X与W形成的共价化合物有很多种 | |
| C. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 提高高锰酸钾的氧化能力,用盐酸酸化 | |
| B. | 抑制Fe2+的水解,用稀硝酸酸化 | |
| C. | 检验某氯代烷烃中含氯元素,加碱溶液加热后用稀硝酸酸化,再加硝酸银溶液检验 | |
| D. | 确认某溶液中含有SO42-时,先加入盐酸酸化,再加氯化钡溶液检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

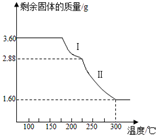
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

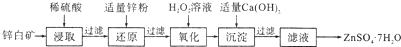
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取时,要求萃取剂的密度比水的密度大 | |
| B. | 蒸馏时,温度计水银球与蒸馏烧瓶支管口相平 | |
| C. | 过滤时,要将待过滤混合物转移到漏斗中 | |
| D. | 分液时,分液漏斗的下口必须紧贴在烧杯壁上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com