
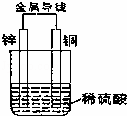
如图所示进行实验,下列说法正确的是( )
|
| A. | 铜片上冒气泡,该气体是H2,铜片是正极,该装置是原电池 |
|
| B. | 锌片质量减小,锌片是负极,发生还原反应 |
|
| C. | 电子流向:锌→导线→铜→稀硫酸→锌,形成一个闭合回路 |
|
| D. | 溶液中的阳离子移向负极,阴离子移向正极 |
| 原电池和电解池的工作原理. | |
| 专题: | 电化学专题. |
| 分析: | 锌、铜和稀硫酸组成的原电池中,锌作负极,负极上锌失电子发生氧化反应;铜作正极,正极上氢离子得电子发生还原反应;电子从负极沿导线流向正极. |
| 解答: | 解:A、Zn、Cu、硫酸构成原电池,实现了化学能转化为电能,锌作负极,负极上锌失电子发生氧化反应;铜作正极,正极上氢离子得电子发生还原反应,产生氢气,故A正确; B、锌、铜和稀硫酸组成的原电池中,锌作负极,负极上锌失电子发生氧化反应,故B错误; C、锌、铜和稀硫酸组成的原电池中,锌作负极,铜作正极,电子从负极沿导线流向正极,电子不能经过电解质,故C错误; D、锌、铜和稀硫酸组成的原电池中,阳离子移向正极,阴离子移向负极,故D错误. 故选A. |
| 点评: | 本题考查学生原电池的工作原理,可以根据所学知识进行回答,难度不大. |


科目:高中化学 来源: 题型:
湿润的淀粉碘化钾试纸接触某气体而显蓝色,该气体可能是①Cl2;②NO2;③H2S;④SO2;⑤溴蒸气;⑥HCl中的( )
A.①③④ B.①②⑤
C.①②⑥ D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D四种元素都是短周期元素。A元素的离子具有黄色的焰色反应。B离子带两个单位正电荷,且B元素的离子结构和Ne具有相同的电子层排布。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构里,最外层电子数是次外层电子数的3倍。根据上述条件,回答:
(1)元素C位于元素周期表中的位置________________,它的最高价氧化物的化学式为_________。
(2)A是______________元素,B是______________元素,
D是______________元素。
(3)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为_________________________________________________________________。
(4) A的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,分别取等物质的量在足量氧气中完全燃烧,耗氧量不同的是( )
|
| A. | 乙炔和乙醛 | B. | 丁酸和乙醛 | C. | 乙二酸和氢气 | D. | 乙烷和甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 原子的最外层电子数是次外层电子数的3倍. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和. |
| E | 生产和生活中用量最大的金属. |
请根据信息回答有关问题:
(1)元素Y的核外电子排布式为 .
(2)元素X与Z可形成化合物XZ2,XZ2属于 晶体,电子式为 .
(3)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号) .
(4)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点最高的是(写化学式) .
(5)R的一种配合物的化学式为RCl3•6H2O.已知0.01mol RCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是 .
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(6)E能形成E2+和E3+两种价态的离子,检验E2+中含有 E3+的最佳试剂是 ,要除去E2+中E3+可加入 ,离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
银锌纽扣电池工作时的反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法不正确的是( )
|
| A. | 锌是阴极,Ag2O是阳极 |
|
| B. | 电解质溶液为碱溶液,不可能是强酸溶液 |
|
| C. | 锌电极的反应式为:Zn+2OH﹣﹣2e﹣=Zn(OH)2 |
|
| D. | 若工作时转移电子0.2mol,则消耗Zn的质量为6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
|
| A. | H2O的沸点比H2S的沸点高是因为O的非金属性比S的非金属性强 |
|
| B. | F2、Cl2、Br2、I2的沸点依次升高是因为它们分子间作用力依次增大 |
|
| C. | 离子化合物溶于水时离子键被破坏,共价化合物溶于水时共价键不一定改变 |
|
| D. | 只含共价键的物质不一定属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结
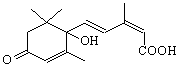 构如右图,下列关于该物质的说法正确的是
构如右图,下列关于该物质的说法正确的是
A.其分子式为C15H18O4
B.既能发生加聚反应,又能发生缩聚反应
C.分子中含有2个手性碳原子
D.既能与FeCl3溶液发生显色反应,又能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,不属于四种基本反应类型是( )
|
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 2HClO═2HCl+O2↑ |
|
| C. | Fe+2FeCl3═3FeCl2 | D. | CuO+CO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com