
未来生活中金属钛的运用越来越广泛,如可在催化剂TiO2作用下,先用NaClO将CN-(毒性很强)氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)乙中反应的离子方程式为__________________________________。
(2)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。则丙中加入的除杂试剂是______(填字母)。
a.饱和食盐水 b.饱和NaHCO3溶液 c.浓NaOH溶液 d.浓硫酸
(3)丁在实验中的作用是____________________________,装有碱石灰的干燥管的作用是____________________________。
(4)戊中盛有含Ca(OH)20.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于________,请说明该测得值与实际处理的百分率相比偏高还是偏低_________?简要说明可能的原因________________________________________________________。
(5)请提出一个能提高准确度的建议(要有可操作性,不宜使操作变得过于复杂)
_________________________________________________________________________
(1)CN-+ClO-=CNO-+Cl- 2CNO-+2H+ +3ClO-=N2↑+2CO2↑+3Cl-+H2O
(2)a
(3)去除Cl2 防止空气中CO2进入戊中影响测定准确度
(4)82% ①装置乙、丙、丁中可能滞留有CO2;②CO2产生的速度较快未与戊中的澄清石灰水充分反应;③Cl2、HCl在丙、丁中未吸收完全。(三点中任意答两点即可,每答对一点给1分,共2分)
(5)建议一:不将甲中溶液一次全部加入乙中,改为分次加入,控制CO2的产生速度;
建议二:乙中瓶塞改为三孔塞,增加的那个孔中插入一根导管到液面以下,反应结束后缓缓通入除去CO2的空气,使装置中滞留的CO2尽可能多的与Ca(OH)2反应。
建议三:将戊中澄清石灰水改为浓度较大的NaOH溶液,反应结束后向戊中加入足量CaCl2后测沉淀质量。等等(三点中任意答一点即可)
解析试题分析:(1)CN-与ClO-生成CNO-和Cl-。CNO-与ClO-酸性条件下生成N2、CO2、Cl-和H2O。
(2)除氯化氢气体不能用饱和碳酸氢钠溶液,因氯化氢与碳酸氢钠生成二氧化碳气体,增加了二氧化碳的量;不能用氢氧化钠溶液,因氢氧化钠溶液也能吸收二氧化碳气体;浓硫酸不能吸收氯化氢气体。a正确。
(3)灼热的铜网可除去氯气。澄清石灰水吸收二氧化碳气体,碱石灰吸收空气中的二氧化碳气体。
(4)由CN-~CNO-~CO2~CaCO3得n(CN-)=0.0082mol,混合溶液中CN-为0.01mol,所以CN-处理百分率为0.82。结果偏低的原因可能是二氧化碳气体残留在系统中没有完全反应、二氧化碳气体产生速率快,来不及与澄清石灰水完全反应、澄清石灰水与氯化氢或氯气发生了反应等。
(5)建议一:将甲中溶液缓慢滴加入乙中,控制二氧化碳气体产生的速率;建议二:将乙中增加一导管,实验结束后从左端鼓入不含二氧化碳气体的空气,使系统中二氧化碳气体完全被澄清石灰水吸收。建议三:将澄清石灰水改为NaOH溶液,反应结束后向戊中加入足量CaCl2后测沉淀质量等。
考点: 化学实验


科目:高中化学 来源: 题型:实验题
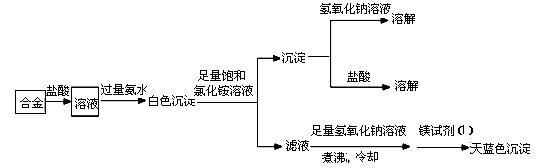
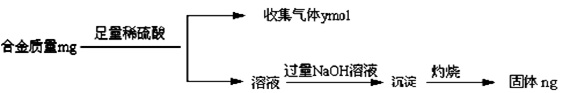
某化学研究性学习小组拟对一种焰火原料(由两种短周期的常见金属单质组成的合金粉末)进行探究。请完成下列探究报告。
【探究目的】探究该焰火原料的组成
【资料检索】①Mg2+检验方法:取2滴待检液,加入2滴2mol·L-1NaOH溶液,再加入1滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+。Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+检出
②Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵
③很多合金是金属互化物,有确定的化学组成
【探究思路】①确定焰火原料所含金属种类;②测定焰火原料的化学式
【实验探究】
(1)甲同学进行了初步试验,实验步骤和实验现象如下。请填写下表。
| 试验序号 | 实 验 步 骤 | 实 验 现 象 | 结 论 |
| ① | 取少量该焰火原料加入冷水 | 无明显现象 | ________________ |
| ② | 取少量该焰火原料加入稀盐酸 | 完全溶解,有大量气体 | _________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
以钡矿粉(主要成份为BaCO3,含有Ca2+、Fe2+、Fe3+、Mg2+等)制备BaCl2·2H2O的流程如下: 
(1)氧化过程主要反应的离子方程式为 。
(2)沉淀C的主要成分是Ca(OH)2和 。由图可知,为了更好的使Ca2+沉淀,还应采取的措施为 。

(3)用BaSO4重量法测定产品纯度的步骤为:
步骤1:准确称取0.4~0.6 g BaCl2·2H2O试样,加入100 ml 水,3 ml 2 mol·L-1的HCl溶液加热溶解。
步骤2:边搅拌,边逐滴加入0.1 mol·L-1 H2SO4溶液。
步骤3:待BaSO4沉降后, ,确认已完全沉淀。
步骤4:过滤,用0.01 mol·L-1的稀H2SO4洗涤沉淀3~4次,直至洗涤液中不含Cl-为止。
步骤5:将折叠的沉淀滤纸包置于 中,经烘干、炭化、灰化后在800℃灼烧至恒重。称量计算BaCl2·2H2O中Ba2+的含量。
①步骤3所缺的操作为 。
②若步骤1称量的样品过少,则在步骤4洗涤时可能造成的影响为 。
③步骤5所用瓷质仪器名称为 。滤纸灰化时空气要充足,否则BaSO4易被残留的炭还原生成BaS,该反应的化学方程式为 。
④有同学认为用K2CrO4代替H2SO4作沉淀剂效果更好,请说明原因 。
[已知:Ksp(BaSO4)=1.1×10-10 Ksp(BaCrO4)=1.2×10-10]
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室用硫酸厂烧渣(主要成分为Fe2O3及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4?7H2O),有关的工艺流程如下:
(1)将过程②中产生的气体通入下列溶液中,溶液不会褪色的是___________(填编号);
| A.品红溶液 | B.紫色石蕊溶液 |
| C.酸性KMnO4溶液 | D.溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O晶体。
已知:常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
| 金属离子 | 氢氧化物开始沉淀的pH | 氢氧化物沉淀完全的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下:
(1)指出提取碘的过程中有关实验操作名称 ① ③
(2)写出过程②中有关反应的离子方程式
(3)提取碘的过程中,可供选择的有机试剂是
| A.乙酸 | B.苯 | C.四氯化碳 | D.酒精 |
| 有机试剂 | 酒精 | 四氯化碳 | 苯 | 乙酸 |
| 毒性 | 无 | 无 | 有 | 无 |
| 水溶性 | 与水以任意比互溶 | 与水互不相溶 | 与水互不相溶 | 与水以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
实验室中某些气体的制取、收集、尾气处理(或性质实验)装置如图所示,用此装置和下表中提供的物质完成相关实验,合理的选项是
| 选项 | I中的物质 | II中收集的气体 | III中的物质 |
| A | Cu和浓硝酸 | NO | NaOH溶液 |
| B | 浓盐酸和MnO2 | Cl2 | NaOH溶液 |
| C | 碳酸钙和盐酸 | CO2 | 澄清石灰水 |
| D | 浓氨水和CaO | NH3 | 酚酞溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是产生和收集气体的实验装置,该装置不适合于 
| A.用锌和盐酸制取H2 |
| B.用NH4Cl和Ca(OH)2制取NH3 |
| C.用电石和饱和食盐水制取C2H2 |
| D.用H2O2在MnO2催化下制O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用如图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是 ( )。
| 选项 | 气体 | a | b | c | d |
| A | SO2 | 浓硫酸 | Cu | H2O | 浓硫酸 |
| B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| C | NH3 | 饱和 NH4Cl溶液 | 消石灰 | 空集气瓶 | 固体 NaOH |
| D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com