
| A、Zn、Fe |
| B、Zn、Ag |
| C、Al、Cu |
| D、Mg、Al |
| m |
| n |
| 27g/mol |
| 3 |
| 11.2L |
| 22.4L/mol |
| 15g |
| 0.5mol |
| 27g/mol |
| 3 |
| 27g/mol |
| 3 |


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
a b |
A、
| ||
B、
| ||
| C、X原子的质量数为a+b | ||
D、一个X原子的质量约为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
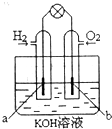
查看答案和解析>>
科目:高中化学 来源: 题型:
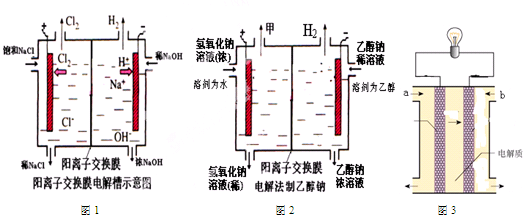
 某课外活动小组进行电解饱和食盐水的实验.请同答下列问题.
某课外活动小组进行电解饱和食盐水的实验.请同答下列问题.
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有X、Y、Z、T、U五种短周期元素.X、Y、Z三元素在周期表中的位置如图所示,三元素的原子序数之和是41.X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物.U单质在Z单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红.
有X、Y、Z、T、U五种短周期元素.X、Y、Z三元素在周期表中的位置如图所示,三元素的原子序数之和是41.X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物.U单质在Z单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4 L CH3CHO中含有的分子数约为6.02×1023 |
| B、56g铁与稀HNO3充分反应,转移电子数为0.3NA |
| C、常温常压下,由6 g NO2和40 g N2O4组成的混合气体中原子总数约为3×6.02×1023 |
| D、80 g NH4NO3晶体中含有NH4+小于 6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com