
| A、含有AlO2-的溶液中:Na+、Al3+、NO3-、Cl- |
| B、使淀粉碘化钾变蓝的溶液中:K+、HCO3-、S2-、SO42- |
| C、能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、Fe3+ |
| D、透明溶液中:Na+、MnO4-、Cl-、SO42- |


科目:高中化学 来源: 题型:
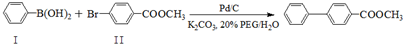

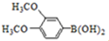 与化合物
与化合物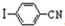 在一定条件可发生类似反应①的反应,其产物的结构简式为
在一定条件可发生类似反应①的反应,其产物的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去KCl溶液中的少量MgCl2,加入适量NaOH溶液,过滤 |
| B、除去FeSO4溶液中少量的CuSO4,加入足量铁屑,充分反应后过滤 |
| C、除去CO2中的少量HCl,通入足量的Na2CO3溶液,收集气体 |
| D、除去N2中的少量O2,通过灼热的炭层,收集气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Fe3+、Cl-、SO32- |
| B、K+、Na+、SO42-、NO3- |
| C、Na+、Cu2+、S2-、NO3- |
| D、Al3+、K+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
物质 组别 | 甲 | 乙 | 丙 |
| A | Mg | FeSO4 | O2 |
| B | Al2O3 | HCl | NaOH |
| C | CO2 | H2O | Na2O2 |
| D | NaHCO3 | Ca(OH)2 | Na2CO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠:供氧剂 |
| B、氧化铝:耐火材料 |
| C、纯碱:胃酸中和剂 |
| D、明矾:净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2>I2>Fe3+ |
| B、Cl2>Fe3+>I2 |
| C、Fe3+>Cl2>I2 |
| D、I2>Cl2>Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com