

| A. | ①②③④⑤ | B. | ①③②⑤④ | C. | ①⑤③②④ | D. | ①③⑤④② |
分析 ①19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体.
③1897年,英国科学家汤姆生发现了电子,1904年提出“葡萄干面包式”的原子结构模型.
②1911年英国物理学家卢瑟福(汤姆生的学生)提出了带核的原子结构模型.
⑤1913年丹麦物理学家波尔(卢瑟福的学生)引入量子论观点,提出电子在一定轨道上运动的原子结构模型.
④奥地利物理学家薛定谔提出电子云模型(几率说),为近代量子力学原子模型.
解答 解:①19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体.
③1897年,英国科学家汤姆生发现了电子,1904年提出“葡萄干面包式”的原子结构模型.
②1911年英国物理学家卢瑟福(汤姆生的学生)提出了带核的原子结构模型.
⑤1913年丹麦物理学家波尔(卢瑟福的学生)引入量子论观点,提出电子在一定轨道上运动的原子结构模型.
④奥地利物理学家薛定谔提出电子云模型(几率说),为近代量子力学原子模型.
故选B.
点评 本题考查了原子的结构和化学史,难度不大,注意基础知识的积累.


科目:高中化学 来源: 题型:解答题
 元素及其化合物的学习和应用是中学化学的主要任务之一.
元素及其化合物的学习和应用是中学化学的主要任务之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化肥名称 | 尿素 | 碳酸氢铵 | 硫酸铵 | 氨水 |
| 溶液的pH | 7 | 8 | 5 | 11 |
| A. | 碳酸氢铵 | B. | 尿素 | C. | 氨水 | D. | 硫酸铵 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
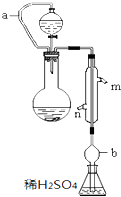 实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:
实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:| 实验 次数 | 氢氧化钠溶液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | |
| 1 | 0.00 | 5.22 |
| 2 | 6.00 | 11.18 |
| 3 | 12.00 | 17.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
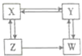 X、Y、Z、W为醇、醛、酸、酯中的一种,它们之间存在如图所示的转化关系.下列判断正确的是( )
X、Y、Z、W为醇、醛、酸、酯中的一种,它们之间存在如图所示的转化关系.下列判断正确的是( )| A. | X是羧酸,Y是酯 | B. | Y是醛,W是醇 | C. | Z是醛,W是羧酸 | D. | X是醇,Z是酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
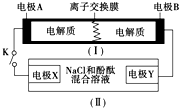 下图为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学反应方程式为:2K2S2+KI3 $?_{充电}^{放电}$K2S4+3KI.装置(Ⅱ)为电解池的示意图.当闭合开关K时,电极X附近溶液先变红.则闭合K时,下列说法正确的是( )
下图为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学反应方程式为:2K2S2+KI3 $?_{充电}^{放电}$K2S4+3KI.装置(Ⅱ)为电解池的示意图.当闭合开关K时,电极X附近溶液先变红.则闭合K时,下列说法正确的是( )| A. | K+从左到右通过离子交换膜 | |
| B. | 电极A上发生的反应为:3I--2e-═I3- | |
| C. | 电极X上发生的反应为:2Cl--2e-═Cl2↑ | |
| D. | 当有0.1 mol K+通过离子交换膜,X电极上产生1.12 L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达平衡时同一物质的V(正)=V(逆) | B. | 是动态平衡 | ||
| C. | 各组分的含量不随时间而变化 | D. | 外界条件不能改变平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com