
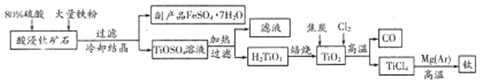
分析 钛铁矿(主要成分为FeTiO3,含少量FeO、A12O3、SiO2等杂质),钛铁矿和浓硫酸混合,钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成,浓硫酸具有强氧化性,+2价Fe具有还原性,则+2价Fe被浓硫酸氧化生成Fe3+,然后向混合物中加入水、铁屑,发生反应2Fe3++Fe=3Fe2+,沉降过滤,滤液中溶质为TiOSO4和FeSO4,将滤液冷却结晶得到绿矾FeSO4•7H2O,TiOSO4溶液加入水并加热,TiO2+水解生成H2TiO3,然后过滤回收硫酸,同时得到H2TiO3,煅烧H2TiO3,H2TiO3分解生成TiO2和水,TiO2能和氯气、C在高温下发生氧化还原反应生成TiCl4,则乙是TiO2,在高温条件下,用Mg和四氯化钛发生置换反应生成Ti.
(1)提高浸出率可从浓度、温度、接触面积等影响化学反应速率的角度解答;FeTiO3与酸反应生成FeSO4、TiOSO4、H2O;
(2)FeSO4溶液加热蒸发浓缩,放在冰水中冷却,冷却结晶,之后过滤,洗涤,低温烘干得到FeSO4•7H20晶体;
(3)TiO2可与焦炭、氯气在高温时反应,该反应中氧化剂为氯气,还原剂为碳,产物为TiC14和CO,根据得失电子守恒书写方程式;
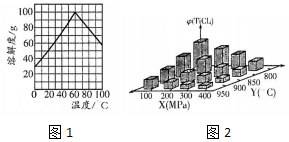
①升高温度,平衡向吸热的方向移动,从图示可知,温度越高,TiC14(g)体积分数φ(TiCl4)越低;
②正反应为放热反应,温度越高,转化率越低,正反应为体积增大的反应,压强越大,转化率越低;
(4)应满足c(TiO2+)×c2(OH-)≥1.0×10-29mol3•L-3,以此计算溶液的c(OH-),可确定溶液的pH.
解答 解:(1)提高浸出率,可增大硫酸浓度、升高温度、边加硫酸边搅拦、增加浸出时间、粉碎成细颗粒,增大接触面积增大反应速率等,酸浸时反应物有硫酸、FeTiO3,生成物有FeSO4、TiOSO4、H2O,反应方程式为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O,离子方程式为FeTiO3+6H+=Fe2++Ti4++3H2O,
故答案为:粉碎矿石,加热反应物;2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O;
(2)根据金属离子沉淀的pH值,然后通过滴加NaOH溶液调节pH至5.0把Al3+除去,过滤,即得到FeSO4溶液,加热浓缩得到60℃饱和溶液,然后放在冰水中冷却至室温,冷却结晶,之后过滤,洗涤,低温烘干,
故答案为:加热浓缩得到60℃饱和溶液,冷却至室温(或0℃)结晶;
(3)TiO2可与焦炭、氯气在高温时反应,该反应中氧化剂为氯气,还原剂为碳,C化合价变化(0→+2),Cl化合价变化(0→-1),根据得失电子守恒,氧化剂氯气,还原剂碳,它们的物质的量相等,则反应的方程式为:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO,
故答案为:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO;
①从图示可知,温度越高,TiC14(g)体积分数φ(TiCl4)越低,说明正反应为放热反应,即△H<0,
故答案为:<;
②从图示可知,正反应为放热反应,温度越高,转化率越低,800℃转化率低,正反应为体积增大的反应,压强越大,平衡向逆反应方向移动,转化率越低,所以α1>α2,
故答案为:>;
(4)当离子浓度等于或小于10-5mol•L-1时可认为完全沉淀,c(TiO2+)×c2(OH-)≥1.0×10-29mol3•L-3,c2(OH-)≥$\frac{1.0×1{0}^{-29}}{1.0×1{0}^{-5}}$,c(OH-)≥1.0×10 -12mol/L,c(H+)≥1.0×10 -2mol/L,PH=2,
故答案为:2.
点评 本题借助制得海绵钛的流程,考查了方程式书写、化学平衡的影响因素、难溶电解质的溶解平衡计算等知识,为高频考点和高考常见题型,充分考查了学生的综合能力,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 熟石灰和水 | B. | 生石灰和水 | ||
| C. | 氯化钠和水 | D. | 氯化铵和氢氧化钡晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ①②③ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 酸性HCl>H2S | 非金属性Cl>S |
| B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
| C | 向NaI溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈紫红色. | I-还原性强于Cl- |
| D | Na在Cl2中燃烧的生成物含离子键 | NaCl固体可导电 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
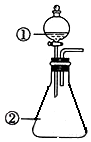 用图装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| D | 液溴 | 苯 | 生成白雾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 宇宙飞船外壳 |  光导纤维 |  宇航服 |  尿不湿 |
| 酚醛树脂 | 二氧化硅 | 聚酯纤维 | 聚丙烯酸钠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比较这两种元素的单质的硬度和熔点 | |
| B. | 向氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液 | |
| C. | 使在空气中久置的镁带和铝片分别与热水作用,并滴入酚酞溶液 | |
| D. | 将铝片和镁片分别投入氢氧化钠溶液中,Al能与NaOH溶液反应放出氢气,而Mg不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林(甲酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 | |
| B. | 溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 | |
| C. | 乙醇(水):加入新制生石灰,蒸馏 | |
| D. | 乙酸(乙醇):加入金属钠,蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ①②④⑦ | C. | ①②⑥⑦ | D. | ③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com