
分析 Fe、FeO、Fe2O3的混合物中加入盐酸恰好使混合物完全溶解,生成了铁的氯化物,因加入KSCN 溶液,无血红色出现,说明只生成氯化亚铁,根据氯元素守恒可知道氯化亚铁的量,进而求得铁元素的质量,根据HCl的物质的量可结合氢气的物质的量可计算O的质量,混合物中=铁元素质量+氧元素质量;
解答 解:用盐酸溶解后,得到的产物加 KSCN 溶液,无血红色出现,说明得到的产物是氯化亚铁,即混合物中的铁元素全在氯化亚铁中,
盐酸的物质的量为:2mol/L×0.1L=0.2mol,
根据氯元素守恒,则n(Fe)=n(FeCl2)=$\frac{1}{2}$×n(HCl)=0.1mol,m(Fe)=0.1mol×56g/mol=5.6g,
根据H元素守恒,有2HCl$\stackrel{FexOy}{→}$H2O,2HCl$\stackrel{Fe}{→}$H2,
生成氢气的物质的量为:n(H2)=$\frac{0.448L}{22.4L/mol}$=0.02mol,消耗HCl的物质的量为:0.02mol×2=0.04mol,
则与氧化物反应的HCl的物质的量为:0.2mol-0.04mol=0.16mol,
所以氧化物中含有n(O)=$\frac{0.16mol}{2}$=0.08mol,m(O)=0.08mol×16g/mol=1.28g,
则混合物的质量=Fe元素质量+O元素质量=5.6g+1.28g=6.88g,
故答案为:6.88.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的化学计算能力.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 石灰石与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 石灰乳与Na2CO3溶液混合:Ca(OH)2+CO32-═CaCO3↓+2OH- | |
| C. | 铁与稀硫酸:2Fe+6H+═2Fe3++3 H2↑ | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ; (2)铝离子的结构示意图:
; (2)铝离子的结构示意图: ;
;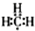
 ; (6)NH4Cl的电子式:
; (6)NH4Cl的电子式: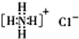 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如表:
车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如表:| 物质 T/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,氯化钙
,氯化钙 ,硫化氢 结构式:H-S-H.以上三种物质中其中属于共价化合物的是H2S,晶体类型为分子晶体.
,硫化氢 结构式:H-S-H.以上三种物质中其中属于共价化合物的是H2S,晶体类型为分子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
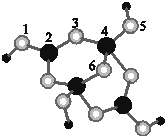 (1)区分晶体和非晶体常用方法为X-射线衍射实验.
(1)区分晶体和非晶体常用方法为X-射线衍射实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 过滤时,应用玻璃棒搅拌漏斗中的待过滤液体 | |
| D. | 称量时,称量物放在称量纸(或称量器皿)上,置于托盘天平的左盘;砝码放在托盘天平的右盘中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com