
某化学课外小组查阅资料发现,实验室制乙烯的反应原理为CH3CH2OH![]() CH2
CH2![]() CH2↑+H2O,制得的乙烯中往往混有CO2、SO2和水蒸气.现拟用下列装置设计一个实验,以验证乙烯中所含杂质气体的成分.
CH2↑+H2O,制得的乙烯中往往混有CO2、SO2和水蒸气.现拟用下列装置设计一个实验,以验证乙烯中所含杂质气体的成分.
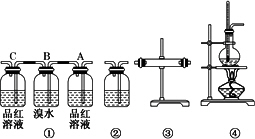
请回答下列问题:
(1)装置的连接顺序(按产物气流从左到右的流向)为________.
(2)装置①中,A瓶中的现象是________,结论为________.B瓶中的现象是________,B瓶中的作用为________.若C瓶中品红溶液不褪色,可得到的结论是________.
(3)装置③中加入的固体药品是________,目的是验证混合气体中含有________,装置②中盛装的溶液是________,目的是验证混合气中含有________.
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:阅读理解
 某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.
某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.| 实验操作 | 实验现象 | |
| 方案一 | 取已除去表面氧化膜的镁条和铝条, 分别和0.1mol?L-1HCl溶液反应 |
均有气泡产生,镁条反应 比铝条反应更剧烈 |
| 方案二 |
查看答案和解析>>
科目:高中化学 来源:高一化学 第3章 重要的有机化合物 3.2.2煤的干馏 苯(鲁科版必修2) 题型:058
某化学课外小组查阅资料知:苯和液溴在有铁存在的条件下可发生反应生 成溴苯和溴化氢,此反应为放热反应.他们用如图所示装置制取溴苯.
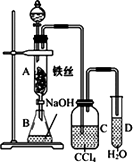
(1)先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.写出A中反应的化学方程式________,观察到A中的现象是_________.实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是__________,写出有关反应的化学方程式________.
(2)C中盛放CCl4的作用是________________.
(3)为证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明.另一种验证的方法是向试管D中加入________,现象是________________.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.
某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.| 实验操作 | 实验现象 | |
| 方案一 | 取已除去表面氧化膜的镁条和铝条, 分别和0.1mol?L-1HCl溶液反应 | 均有气泡产生,镁条反应 比铝条反应更剧烈 |
| 方案二 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省吉安市永新县任弼时中学高三(上)月考化学试卷(9月份)(解析版) 题型:解答题
| 实验操作 | 实验现象 | |
| 方案一 | 取已除去表面氧化膜的镁条和铝条, 分别和0.1mol?L-1HCl溶液反应 | 均有气泡产生,镁条反应 比铝条反应更剧烈 |
| 方案二 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com