
【题目】25℃时,在含有大量PbI2的饱和溶液中存在着平衡PbI2(s)![]() Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是( )
Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是( )
A.平衡逆向移动I-浓度减小B.溶度积常数Ksp减小
C.沉淀溶解平衡不移动D.PbI2的溶解度减小
【答案】D
【解析】
含有大量PbI2的饱和溶液中存在着平衡PbI2(s)![]() Pb2+(aq)+2I-(aq),加入KI溶液,c(I-)增大,沉淀溶解平衡逆移,c(Pb2+)减小,溶度积常数Ksp只与温度有关。
Pb2+(aq)+2I-(aq),加入KI溶液,c(I-)增大,沉淀溶解平衡逆移,c(Pb2+)减小,溶度积常数Ksp只与温度有关。
A. 含有大量PbI2的饱和溶液中存在着平衡PbI2(s)![]() Pb2+(aq)+2I-(aq),加入KI溶液,c(I-)增大,沉淀溶解平衡左移,故A错误;
Pb2+(aq)+2I-(aq),加入KI溶液,c(I-)增大,沉淀溶解平衡左移,故A错误;
B. 溶度积常数Ksp只与温度有关,改变c(I-)Ksp不变,故B错误;
C. 加入KI溶液,c(I-)增大,沉淀溶解平衡逆移,故C错误;
D.加入KI溶液,c(I-)增大,沉淀溶解平衡逆移,PbI2的溶解度减小,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
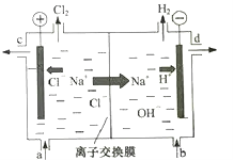
完成下列填空:
(1)写出电解饱和食盐水的离子方程式___。
(2)精制饱和食盐水从图中___位置补充,氢氧化钠溶液从图中___位置流出(选填“a”、“b”、“c”或“d”)。
(3)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。
写出该反应的化学方程式___。
(4)室温下,0.1mol/LNaClO溶液的pH___0.1mol/LNa2SO3溶液的pH(选填“大于”、“小于”或“等于”)。
(5)浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为___。
已知:H2SO3:Ki1=1.54×102,Ki2=1.02×107,HClO:Ki1=2.95×108,H2CO3:Ki1=4.3×107,Ki2=5.6×1011。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,NH4+的水解平衡常数为Kb=5.556×10 -10。该温度下,用0.100 mol·L-1的氨水滴定10.00ml 0.050 mol·L-1的二元酸H2A的溶液,滴定过程中加入氨水的体积(V 与溶液中lg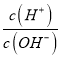 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
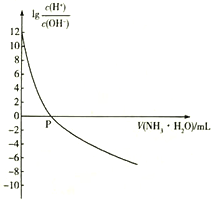
A. H2A的电离方程式为H2A![]() H++A2-
H++A2-
B. 25℃时,Kb(NH3·H2O)=1.8×10-5
C. P点时加入氨水的体积为10 mL
D. 向H2A溶液中滴加氨水的过程中,水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.新制的氯水放置一段时间,溶液的pH会减小
B.在配制硫酸亚铁溶液时往往要加入少量铁粉
C.恒容容器中反应CO(g)+NO2(g)![]() CO2(g)+NO(g) △H<0达到平衡后,升高温度,气体颜色变深
CO2(g)+NO(g) △H<0达到平衡后,升高温度,气体颜色变深
D.增大压强,有利于SO2与O2反应生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两个电解池均以Pt为电极,且互相串联,甲池盛有AgNO3溶液,乙池中盛有一定量的某盐溶液,通电一段时间后,测得甲池中某电极质量增加2.16 g,乙池中某电极上析出0.24 g金属,则乙池中溶质可能是( )
A.KNO3B.MgSO4C.CuSO4D.Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:xA(气)+yB(气)![]() zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
A. x+y<z B. 平衡向右移动
C. B的转化率升高 D. C的体积分数降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A. 图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
B.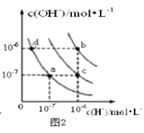 图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性
图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性
C.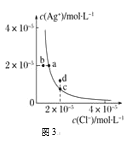 图3中d点没有AgCl沉淀生成
图3中d点没有AgCl沉淀生成
D.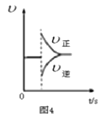 图4表示在N2(g)+3H2(g)
图4表示在N2(g)+3H2(g)![]() 2NH3(g)达到平衡后,减小NH3浓度时速率的变化
2NH3(g)达到平衡后,减小NH3浓度时速率的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3+与SCN-形成的配离子颜色极似血液,常被用于电影特技和魔术表演。回答下列问题:
(1)写出Fe3+的电子排布式:___________;SCN-的结构式为________
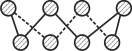
(2)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为_________。硫的一种同素异形体分子式为S8,其结构如图所示,其中S原子的杂化轨道类型为______。S8易溶于二硫化碳的原因是__________________________________________________。
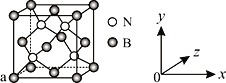
(3)已知立方氮化硼晶体内存在配位键,则其晶体中配位键与普通共价键数目之比为______。原子坐标参数可表示晶胞内部各原子的相对位置,图中a处B的原子坐标参数为(0, 0, 0),则距离该B原子最近的N原子坐标参数为_________。
(4)单质铁的晶体结构如图所示,该堆积方式名称为________。已知该晶胞的密度为ρ g/cm3,则铁原子半径的计算式为______________ pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以活性炭为催化剂,可以将工业废气中的SO2催化氧化变为硫酸,进而制得各种硫酸盐,如硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]等。
(1)研究表明,SO2在活性炭上催化氧化的反应机理可以表示为(*标记的为吸附状态)
Ⅰ.二氧化硫的吸附:SO2(g)![]() SO2* ΔH1=a kJ·mol-1
SO2* ΔH1=a kJ·mol-1
Ⅱ.氧气的吸附:O2(g)![]() 2O* ΔH2=b kJ·mol-1
2O* ΔH2=b kJ·mol-1
Ⅲ.三氧化硫的氧化:SO2*+O*=SO3* ΔH3=c kJ·mol-1
Ⅳ.三氧化硫的脱附:SO3*![]() SO3(g) ΔH4=d kJ·mol-1
SO3(g) ΔH4=d kJ·mol-1
根据上述反应机理,写出SO2在活性炭上催化氧化的热化学方程式____。
(2)以硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为原料通过下列流程可以制备晶体A。

①已知25 ℃时,[Fe(C2O4)3]3-(aq)+SCN-(aq)![]() [Fe(SCN)]2+(aq)+3C2O42-(aq),K=10-16。某研究小组同学欲检验晶体A中含有三价铁,取少量晶体放入试管中,用蒸馏水充分溶解,向试管中滴入几滴0.1 mol·L-1KSCN溶液。请判断上述实验方案是否可行并说明理由:____。
[Fe(SCN)]2+(aq)+3C2O42-(aq),K=10-16。某研究小组同学欲检验晶体A中含有三价铁,取少量晶体放入试管中,用蒸馏水充分溶解,向试管中滴入几滴0.1 mol·L-1KSCN溶液。请判断上述实验方案是否可行并说明理由:____。
②某研究小组通过如下实验步骤测定晶体A的化学式:
步骤1:准确称取A样品4.910 0 g,干燥脱水至恒重,残留物质量为4.370 0 g;
步骤2:准确称取A样品4.910 0 g置于锥形瓶中,加入足量的3.000 mol·L-1 H2SO4溶液和适量蒸馏水,用0.500 0 mol·L-1 KMnO4溶液滴定,当MnO4-恰好完全被还原为Mn2+时,消耗KMnO4溶液的体积为24.00 mL;(C2O42-+MnO4-+H+→CO2↑+Mn2++H2O)
步骤3:将步骤1所得固体溶于水,加入铁粉0.280 0 g,恰好完全反应。
通过计算确定晶体A的化学式(写出计算过程)。_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com