
| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| n(NO2)/mol | 0.400 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
分析 (1)依据热化学方程式和盖斯定律计算得到,a、N2(g)+2O2(g)=N2O4(g)△H=10.7kJ•mol-1;b、N2H4(g)+O2 (g)=N2(g)+2H2O(g)△H=-543kJ•mol-1,由盖斯定律b×2-a得到;
(2)A.单位时间内生成1molN2O4的同时生成2molNO2,说明正逆反应速率相同;
B.反应是放热反应,达到平衡后,其它条件不变,升高温度,平衡逆向进行;
C.置于绝热的恒容容器中,容器中气体颜色不变时,浓度不变;
D.加入适当的催化剂改变反应速率,不能改变化学平衡;
(3)①根据公式反应速率v=$\frac{△c}{△t}$来计算;
②反应是放热反应,升温平衡逆向进行,平衡常数减小;
③根据各组分的浓度变化量之比等于系数值比来计算;
(4)①依据亚硝酸钠中元素化合价代数和为0计算,元素化合价处于中间价态具有氧化性和还原性;
②亚硝酸属于弱酸,则NaNO2溶液中亚硝酸根离子水解显碱性;
(5)燃料电池中,负极上燃料失电子发生氧化反应.
解答 解:(1)a、N2(g)+2O2(g)=N2O4(g)△H=10.7kJ•mol-1;
b、N2H4(g)+O2 (g)=N2(g)+2H2O(l)△H=-624kJ•mol-1
由盖斯定律b×2-a得到 2H2N4(g)+N2O4(g)=3N2(g)+4H2O(l)△H=-1258.7kJ/mol,
故答案为:2H2N4(g)+N2O4(g)=3N2(g)+4H2O(l)△H=-1258.7kJ/mol;
(2)一定温度下,在密闭容器中可逆反应:2NO2(g)?N2O4(g)△H<0,
A.单位时间内生成1molN2O4的同时生成2molNO2,说明正逆反应速率相同,反应达到平衡状态,故A正确;
B.反应是放热反应,达到平衡后,其它条件不变,升高温度,平衡逆向进行,二氧化氮浓度增大气体颜色加深,故B错误;
C.反应是放热反应,置于绝热的恒容容器中,容器中气体颜色不变时,浓度不变,说明反应达到平衡状态,故C正确;
D.加入适当的催化剂改变反应速率,不能改变化学平衡,反应物转化率不变,故D错误;
故答案为:A C;
(3)①图表数据分析可知,反应开始直至10min时,N2O4的平均反应速率=$\frac{\frac{0.05mol}{2L}}{10min}$=0.025mol/L•min,
故答案为:0.0025mol/L•min;
②在100℃时,将0.400mol的NO2气体充入2L的容器中反应是放热反应,升温平衡逆向进行,平衡常数减小,
故答案为:减低;
③2NO2?N2O4
起始浓度(mol•L-1) 0.2 0
转化浓度(mol•L-1) 0.08 0.04
平衡浓度(mol•L-1) 0.12 0.04
若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是c,则
N2O4 ?2NO2
起始浓度(mol•L-1) c 0
转化浓度(mol•L-1) c-0.04 0.12
平衡浓度(mol•L-1)0.04 0.12
所以$\frac{c-0.04}{0.12}$=0.5,解得c=0.10mol/L,
物质的量0.10mol/L×2L=0.2mol
故答案为:0.200mol;
(4)①NaNO2)中钠元素化合价+1价,氧元素化合价-2价,元素化合价代数和为0计算得到氮元素化合价+3价,居于氮元素的中间价态,所以既有氧化性,也有还原性,
故答案为:+3,C;
②亚硝酸属于弱酸,则NaNO2溶液中亚硝酸根离子水解显碱性,离子方程式为:NO2-+H2O?HNO2+OH-,
故答案为:NO2-+H2O?HNO2+OH-;
(5)肼--空气碱性燃料电池中,负极上燃料失电子和氢氧根离子反应生成氮气和水,电极反应式为N2H4-4e-+4OH-═N2+4H2O,
故答案为:N2H4-4e-+4OH-═N2+4H2O.
点评 本题考查了热化学方程式书写和盖斯定律计算,化学平衡的影响因素分析和化学平衡的计算应用,原电池原理分析,掌握基础是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
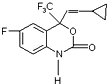 M是一种治疗艾滋病的新药(结构简式见图),已知 M的分子中-NH-COO-基团(除H外)与苯环在同一个平面内,关于M的以下说法正确的是( )
M是一种治疗艾滋病的新药(结构简式见图),已知 M的分子中-NH-COO-基团(除H外)与苯环在同一个平面内,关于M的以下说法正确的是( )| A. | 该物质易溶于水 | |
| B. | M能发生缩聚反应 | |
| C. | M分子内至少有15个原子在同一个平面上 | |
| D. | M的分子式为C13H22O2NF4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BF3是三角锥形分子 | |
| B. | NH4+的电子式: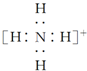 ,离子呈平面形结构 ,离子呈平面形结构 | |
| C. | CH4分子中的4个C-H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键 | |
| D. | CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C-H σ键D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>0 | |
| B. | 每生成1mol水,转移8mol电子 | |
| C. | 氧化产物与还原产物的质量比为2:1 | |
| D. | N2H4是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 阿司匹林的分子式为C9H10O4 | B. | 阿司匹林属于有机高分子化合物 | ||
| C. | 1mol阿司匹林最多能与5molH2加成 | D. | 阿司匹林具有酸性,能与NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{20}$mol | B. | $\frac{1}{10}$mol | C. | $\frac{1}{5}$mol | D. | $\frac{2}{5}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
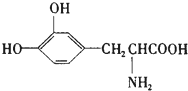
| A. | 只能与碱反应,不能与酸反应 | B. | 1mol该物质最多可与4molNaOH反应 | ||
| C. | 该物质不能使酸性KMnO4褪色 | D. | 1mol该物质最多可与1molHBr反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验后剩余的钠粒可放回原试剂瓶中 | |
| B. | 刚刚切开的钠的银白色断面会很快变暗 | |
| C. | 自然界中无游离态的钠存在 | |
| D. | 钠在空气中加热生成氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先生成白色沉淀,加入足量氨水后沉淀消失 | |
| B. | 生成的沉淀为AgCl,它不溶于水,但溶于氨水,重新电离成Ag+和Cl- | |
| C. | 生成的沉淀是AgCl,加入氨水后生成了可溶性的配合物[Ag(NH3)2]Cl | |
| D. | 若向AgNO3溶液中直接滴加氨水,产生的现象也是先出现白色沉淀后沉淀消失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com