
分析 (1)该溶液中c(H+)=0.1mol/L×0.1%=10-4 mol/L,pH=-lgc(H+);
(2)该溶液中HA电离出的c(H+)=10-4 mol/L,水电离出的c(H+)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10mol/L;
(3)HA电离平衡常数Ka=$\frac{c({A}^{-})•c({H}^{+})}{c(HA)}$;弱电解质的电离是吸热反应,升高温度促进弱电解质电离,溶液中氢离子浓度增大;
(4)A-+H2O?HA+OH-,设氢氧根离子的浓度为xmol/L,而K=$\frac{{K}_{w}}{{K}_{a}}$=$\frac{1{0}^{-14}}{1{0}^{-7}}$=10-7,$\frac{{x}^{2}}{0.1-x}$=10-7,所以x=10-4mol/L.
解答 解:(1)该溶液中c(H+)=0.1mol/L×0.1%=10-4 mol/L,pH=-lgc(H+)=-lg10-4=4,
故答案为:4;
(2)该溶液中HA电离出的c(H+)=10-4 mol/L,水电离出的c(H+)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10mol/L,所以由HA电离出的c(H+)与水电离出的c(H+)比=10-4 mol/L:10-10mol/L=106,
故答案为:106;
(3)HA电离平衡常数Ka=$\frac{c({A}^{-})•c({H}^{+})}{c(HA)}$=$\frac{1{0}^{-4}×1{0}^{-4}}{0.1}$=10-7,弱电解质的电离是吸热反应,升高温度促进弱电解质电离,所以电离平衡常数增大,溶液中氢离子浓度增大,溶液的pH减小,故答案为:10-7;增大;减小;
(4)A-+H2O?HA+OH-,设氢氧根离子的浓度为xmol/L,而K=$\frac{{K}_{w}}{{K}_{a}}$=$\frac{1{0}^{-14}}{1{0}^{-7}}$=10-7,$\frac{{x}^{2}}{0.1-x}$=10-7,所以x=10-4mol/L,所以pOH=4,则pH=10,故答案为:10.
点评 本题考查弱电解质的电离,为高频考点,明确弱电解质电离特点是解本题关键,易错点是水电离出c(H+)的计算,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NaHCO3水解的离子方程式:HCO3-+H2O?CO32-+H2O- | |
| B. | Ca(OH)2的电离方程式:Ca(OH)2?Ca2++2OH- | |
| C. | AgCl 的沉淀溶解平衡表达式:AgCl(s)?Ag+(aq)+CI“(aq) | |
| D. | Na2S 水解的离子方程式:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质编号 | 物质转化关系 | a | b | c | d |
| ① | 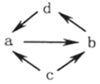 | NO | NO2 | N2 | HNO3 |
| ② | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
| ③ | SiO2 | Na2SiO3 | Si | H2SiO3 | |
| ④ | SO2 | SO3 | S | H2SO4 |
| A. | ①② | B. | ②③ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ②④ | C. | ①②⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| B. | 新制氯水中:Cl2+H2O?2H++ClO-+Cl- | |
| C. | 200 mL 2 mol/L的FeBr2溶液中通入11.2L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热胆矾失去结晶水,得到白色无水硫酸铜,这一过程叫风化 | |
| B. | 家用石碱(主要成分是Na2CO3•10H2O )久置后,由块状变成粉末状,这一变化是风化的结果 | |
| C. | 含有水蒸气的气体通过固体NaOH 时,固体表面出现水珠,这是固体氢氧化钠潮解的原故 | |
| D. | 从冰箱取出物品,表面很快出现水珠,这种现象叫潮解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①④ | C. | ①③ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com