
| A. | 铜$\stackrel{浓硫酸}{→}$硝酸铜 | B. | 铜$\stackrel{稀硫酸}{→}$硝酸铜 | ||
| C. | Cu$\stackrel{Cl_{2}}{→}$CuCl2$\stackrel{AgNO_{3}}{→}$Cu(NO3)2 | D. | Cu$\stackrel{空气}{→}$CuO$\stackrel{HNO_{3}}{→}$Cu(NO3)2 |
分析 用铜制取硝酸铜的最佳方法应是:从经济角度出发,制取等量的硝酸铜时,所用的原料最少,成本最低;从环境保护的角度出发,制取硝酸铜时不生成对环境造成污染的气体,以此来解答.
解答 解:A.Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,反应生成NO2气体,污染环境,故A不选;
B.3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,反应生成NO气体,污染环境,故B不选;
C.氯气有毒,且硝酸银价格较高,不符合节约原料和防止环境污染,故C不选;
D.2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+2HNO3=Cu(NO3)2+H2O,从过程可以看出该过程不会产生有毒气体,环保且没有多消耗原料,不生成污染性气体,故D选;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质制备实验及节约原料和防止环境污染,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
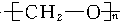 ,它是通过加聚反应制得的,则合成象牙的单体是( )
,它是通过加聚反应制得的,则合成象牙的单体是( )| A. | (CH3)2O | B. | CH3CHO | C. | HCHO | D. | C2H2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷 | B. | 乙烷 | C. | 丙烷 | D. | 丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
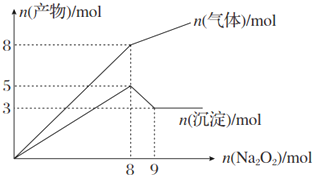
| A. | 2 mol、3 mol、4 mol | B. | 2 mol、3 mol、8 mol | ||
| C. | 3 mol、2 mol、8 mol | D. | 3 mol、2 mol、4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫是氧化剂,KOH是还原剂 | |
| B. | 反应中共转移4摩尔电子 | |
| C. | 还原剂和氧化剂质量比是1:2 | |
| D. | 氧化产物和还原产物的质量比是1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com