
设NA为阿伏加德罗常数,下列叙述中正确的是
A 常温下11.2L的甲烷气体含有甲烷分子数为0.5NA个
B 14g乙烯和丙烯的混合物中总原子数为3NA个
C 0.1mol/L的氢氧化钠溶液中含钠离子数为0.1NA个
D 5.6g铁与足量的稀硫酸反应失去电子数为0 .3NA个
.3NA个
科目:高中化学 来源: 题型:
0.1 mol NaHCO3中含有 ( )
A.0.2 mol Na+ B.0.05 mol CO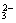 C.6.02×1023个 O D.0.1 mol H
C.6.02×1023个 O D.0.1 mol H
查看答案和解析>>
科目:高中化学 来源: 题型:
设nA为阿伏伽德罗常数的数值,下列说法正确的是
A、常温下,23g NO2含有nA个氧原子
B、1L0.1mol•L-1的氨水含有0.1nA个OH―
C、常温常压下,22.4LCCl4含有个nA个CCl4分子
D、1molFe2+ 与足量的H2O2溶液反应,转移2nA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
设nA代表阿伏加德罗常数(NA)的数值,下列说法正确的是( )
A.1 mol硫酸钾中阴离子所带电荷数为nA
B.乙烯和环丙烷(C3H6)组成的28 g混合气体中含有3nA个氢原子
C.标准状况下,22.4 L氯气与足量氢氧化钠溶液反 应转移的电子数为nA
应转移的电子数为nA
D.将0.1 mol氯化铁溶于1 L水中,所得溶液含有0.1nA个Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是:
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A. 一定温度、压强下,气体体积由其分子的大小决定
B. 一定温度、压强下,气体体积由其物质的量的多少决定
C. 气体摩尔体积是指1mol任何气体所占的体积为22.4L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA代表阿伏加德罗常数,下列说法正确的是
A.0.5 mol Al与足量盐酸反应转移电子数为1 NA
B.标准状况下,11.2 L SO3所含的分子数为0.5 NA
C.0.1 mol CH4所含的电子数为1 NA
D.46 g NO2和N2O4的混合物含有的分子数为1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:

请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为______________________________。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为_____________________________。
(3)验证滤液B含Fe3+,可取少量滤液并加入_______________(填试剂名称)。
(4)滤液D产生沉淀F的离子方程式为______________________________。
(5)滤液E、K中溶质的主要成分是____(填化学式),写出该溶质的一种用途_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com