
【题目】离子交换法制取纯净水的过程如下图所示。
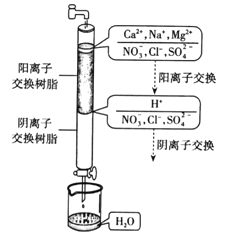
请根据图示回答下列问题:
(1)若水龙头中出来的是硬水,则其中含有较多的___离子。
(2)阳离子交换树脂中所含的大量阳离子是___,根据电荷守恒可知,通过阳离子交换树脂后,水中阳离子的数目___(填“增多”、“减少”或“不变”)。
(3)水中的NO3、Cl、SO42,通过阴离子交换树脂转化为___离子,进而与H+反应生成H2O,有关反应的离子方程式为___。
(4)通过净化处理后,水的导电能力___(填“增强”、“减弱”或“不变”),原因是____。
【答案】Ca2+、Mg2+ H+ 增多 OH- H++ OH-=H2O 减弱 水中的离子浓度减小
【解析】
(1)根据硬水的概念分析判断;
(2)根据图示,结合水经过阳离子交换树脂成分的变化分析判断;
(3)根据图示,经过阴离子交换树脂水的成分的变化分析解答;
(4)导电能力与溶液中的离子浓度的大小有关,据此分析解答。
(1)硬水是指含有较多可溶性钙、镁化合物的水,则其中含有较多的Ca2+、Mg2+,故答案为:Ca2+、Mg2+;
(2)根据图示,阳离子交换树脂中所含的大量阳离子是H+,经过阳离子交换树脂后,硬水中的Ca2+、Mg2+、Na+被H+代替,根据电荷守恒可知,通过阳离子交换树脂后,水中阳离子的数目增多,故答案为:H+;增多;
(3)根据图示,水中的NO3、Cl、SO42,通过阴离子交换树脂转化为OH-离子,进而与H+反应生成H2O,反应的离子方程式为H++ OH-=H2O,故答案为:OH-;H++ OH-=H2O;
(4)通过净化处理后,水中的离子浓度减小,导电能力减弱,故答案为:减弱;水中的离子浓度减小。


 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2(体系均为酸性条件),它们使用的药品和装置如图所示:

(1)SO2气体还原Fe3+后的所有产物有___________(填离子符号),参加反应的SO2和Fe3+的物质的量之比是______________;
(2)写出装置B中反应的离子方程式________________________;装置C的作用是________________________。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、然后干燥,在这一系列操作中没有用到的仪器是____________
A、蒸发皿 B、石棉网 C、漏斗 D、玻璃棒 E、坩埚
(4)在上述装置中通入过量的SO2,为了验证SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分为三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去;
方案②:往第二份试液中加入KSCN溶液(硫氰化钾,遇到Fe3+时溶液变成血红色),溶液不变红,再加入某种氧化剂,溶液变红;
方案③:往第三份试液中加入用盐酸酸化的BaCl2溶液,产生白色沉淀。
上述方案不合理的是_______________,原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是温度和压强对反应X+Y![]() 2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
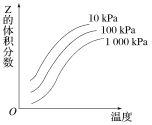
A.上述可逆反应的正反应为放热反应B.X、Y、Z均为气态
C.X和Y中最多只有一种为气态,Z为气态D.上述反应的逆反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4 L水含有的水分子数为NA
B. 常温常压下,22 g CO2含有的CO2分子数为0.5NA
C. 标准状况下,32 g O2和CO2的混合气体含有的氧原子数为2NA
D. 40 g NaOH溶解在1 L水中,得到溶液的物质的量浓度为1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是对某溶液进行离子检测的方法和结论,其中正确的是( )
A. 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
B. 加入足量的CaCl2溶液,产生白色沉淀,则溶液中一定含有大量的CO![]()
C. 加入NaOH溶液后加热产生有刺激性气味的气体,则溶液中一定含有大量的NH![]()
D. 先加入适量的盐酸酸化,再加入AgNO3溶液,产生白色沉淀,则溶液中一定含有大量的Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2C12)是工业上常用的硫化剂。常温下是一种液体,沸点137℃,易与水反应。实验室可通过硫与少量氯气在110140℃反应制得S2Cl2粗品,氯气过量则会生成SCl2。
(1)选取以下装置制取少量S2Cl2:

①仪器m的名称为_____________。
②装置连接顺序:A→________________________________→E→D。
③A中发生反应的离子方程式为 _________________________。
④装置F的作用是____________________。
⑤D中的最佳试剂是__________(填标号)。
a.碱石灰 b.浓硫酸 c.无水氯化钙
⑥为了提高S2Cl2的纯度,关键的是控制好温度和_______________________。
(2)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合物的SO2的体积分数。

①W溶液可以是下列溶液中的__________(填标号);
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为__________(含V、m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化:
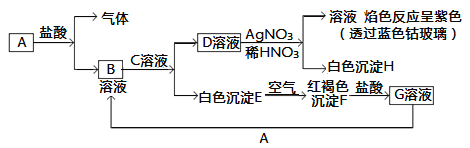
试回答:
(1)写出B的化学式________,D的化学式________。
(2)写出由E转变成F的化学方程式________________________。
(3)写出用KSCN鉴别G溶液的离子方程式________________;向G溶液加入A的有关离子反应方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水体中硝酸盐造成的污染已成为突出的环境问题。某课题组研究了去除不同各种水体中NO3-的方法。
(1)用铝粉去除饮用水中NO3-的一种方案如下:

①用熟石灰而不用NaOH调节pH的主要原因是___。在调节pH时,若pH过大或过小都会造成Al的利用率降低。写出pH过大造成Al利用率降低的离子方程式___。
②在加入铝粉去除NO3-的反应中,氧化产物和还原产物的物质的量之比为___。
(2)用铁粉处理pH=2.5的含NO3-废水,测得溶液中相关离子浓度、pH随时间的变化关系如图(部分副反应产物略去):

①t1时刻前,该反应的离子方程式为___。
②研究表明:铁粉还原含NO3-废水时,加入活性碳粉可以提高去除NO3-的速率,可能的原因是___。
(3)用Pt作电极电解含NO3-的酸性废水,原理如图。N为电源的___(选填“正”或 “负”)极,与直流电源M端相连的Pt电极上的电极反应式为___。

(4)课题组以钛基氧化物涂层材料为惰性阳极、碳纳米管修饰的石墨为阴极,控制一定条件,电解含大量NO3-、SO42-的废水,可使NO3-变为NH4+。研究发现:其他条件不变,废水中加一定量NaCl,去除NH4+的效果明显提高,溶液中氮元素含量显著降低,可能的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3和NaHCO3是两种常见的钠盐.
(1)用洁净的铂丝蘸取Na2CO3粉末置于酒精灯火焰上灼烧,火焰呈_____色.
(2)等质量的Na2CO3和NaHCO3分别与足量的盐酸反应,在相同条件下产生CO2的体积V(Na2CO3)_____V(NaHCO3)(填“大于”,“小于”或“等于”)
(3)若加热10.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g,则原混合物中碳酸钠的质量分数为_____.
(4)实验室中需2mol/L的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3的质量是_____.
A. 1000mL; 212g B.950mL;543.4g C.任意规格; 572g D.500mL; 106g
(5)若出现如下情况,其中将引起所配溶液浓度偏高的是_____(填下列编号);
A.容量瓶实验前用蒸馏水洗干净,但未烘干
B.定容观察液面时俯视
C.未冷却至室温就开始定容
D.加蒸馏水时不慎超过了刻度.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com