
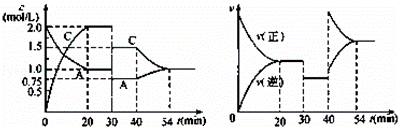
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)⇌2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如图所示.下列说法中正确是( )
|
| A. | 30 min~40 min间该反应使用了催化剂 |
|
| B. | 反应方程式中的x=1,正反应为吸热反应 |
|
| C. | 30~40min改变的条件是将容器的体积扩大至原来的2倍 |
|
| D. | 在25min、35min、55min时化学平衡常数分别为K1、K2、K3,则K1=K2>K3 |
| 化学平衡建立的过程;物质的量或浓度随时间的变化曲线. | |
| 专题: | 化学平衡专题. |
| 分析: | A.由图象可知,30min﹣40min之间,反应速率降低了,平衡不移动,反应物与生成物的浓度瞬时降低,催化剂不能改变浓度; B.由开始到达到平衡,A、B的浓度减少的量相同,由此可知x=1.则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应; C、由图象可知,30min时正、逆反应速率降低,A、C的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,根据浓度变化计算体积扩大倍数; D.由C中分析可知,30~40 min改变的条件是降低压强,故25 min、35 min是温度相同,平衡常数相同.由图可知,40min时改变的条件,瞬间A、C的浓度不变,正、逆速率都增大,应为升高温度,到达平衡时A的浓度降低,C的浓度增大,平衡向逆反应移动. |
| 解答: | 解:A.由图象可知,30~40 min只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,故A错误; B.由开始到达到平衡,A、B的浓度减少的量相同,由此可知x=1,反应前后气体体积不变,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡逆向移动,应是升高温度,则正反应为放热反应,故B错误; C、由图象可知,30min时正、逆反应速率降低,A、C的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,A的浓度由1mol/L变为0.75mol/L,故体积变为原来的 D.由C中分析可知,30~40 min改变的条件是降低压强,故25 min、35 min是温度相同,平衡常数相同,故K2=K1.由图可知,40min时改变的条件,瞬间A、C的浓度不变,正、逆速率都增大,应为升高温度,到达平衡时A的浓度降低,C的浓度增大,平衡向逆反应移动,平衡常数减小,故则K3<K2=K1,故D正确; 故选D. |
| 点评: | 本题考查化学平衡图象问题,题目难度较大,注意根据图象浓度的变化以及反应速率的变化判断化学反应状态以及影响反应速率的条件,本题易错,答题时注意思考,D选项注意根据54min平衡时浓度变化判断. |


科目:高中化学 来源: 题型:
下列乙醇的化学性质不是由羟基所决定的是( )
A.跟金属钠反应
B.在足量氧气中完全燃烧生成CO2和H2O
C.在浓H2SO4存在时发生消去反应,生成乙烯
D.当银或铜存在时跟O2发生反应,生成乙醛和水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关晶体和非晶体的说法中正确的是( )
A.具有规则几何外形的固体均为晶体
B.晶体具有自范性,非晶体没有自范性
C.晶体研碎后即变为非晶体
D.将玻璃加工成规则的固体即变成晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )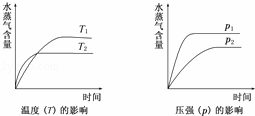
|
| A. | CO2(g)+H2(g)⇌CO(g)+H2O(g);△H>0 |
|
| B. | CO2(g)+2NH3(g)⇌CO(NH2)2(s)+H2O(g);△H<0 |
|
| C. | CH3CH2OH(g)⇌CH2=CH2(g)+H2O(g);△H>0 |
|
| D. | 2C6H5CH2CH3(g)+O2(g)⇌2C6H5CH═CH2(g)+2H2O(g);△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行反应:A(g)+3B(g)⇌2C(g),有关下列图象说法的不正确的是( )

|
| A. | 依据图a可判断正反应为放热反应 |
|
| B. | 在图b中,虚线可表示使用了催化剂 |
|
| C. | 若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动 |
|
| D. | 由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取.已知:
| 乙醇 | 四氯化碳 | 裂化汽油 | 碘(晶体) | |
| 密度/g•cm﹣3 | 0.7893 | 1.595 | 0.71~0.76 | 4.94 |
| 沸点/℃ | 78.5 | 76.8 | 25~232 | 184.35 |
以下为某兴趣小组模拟从紫菜提取碘单质的过程:
紫菜→(焙烧)→(浸取) (操作①)
(操作①) (操作②)→(蒸馏)→粗产品
(操作②)→(蒸馏)→粗产品
(1)实验室中焙烧紫菜用到的仪器有 .
A.烧杯 B.蒸发皿 C.坩埚 D.试管 E.酒精灯 F.泥三角
(2)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,写出反应的离子方程式 .
(3)操作①的名称是 ;试剂A为 (填本题表格中一种最佳化学试剂的名称),不使用另外两种试剂的主要原因分别是:
Ⅰ ;
Ⅱ .
(4)操作②应在 (仪器名称)中振荡、静置,操作时先分离出的是 .
(5)将下列装置图中缺少的必要仪器补画出来以最终将单质碘与试剂A分离: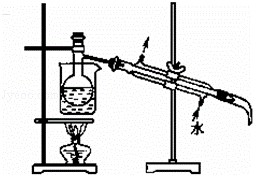
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常利用CO与SO2反应生成固态S单质和CO2,从而消除这两种气体对大气的污染:2CO(g)+SO2(g) 2CO2(g)+S(s)△H=﹣a kJ/mol(a>0),下列叙述正确的是( )
2CO2(g)+S(s)△H=﹣a kJ/mol(a>0),下列叙述正确的是( )
A.该反应的平衡常数表达式为K=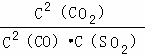
B.若反应开始时投入2 mol CO,则达平衡时,放出热量为a kJ
C.增大压强或升高温度都可以加快化学反应速率并提高SO2的转化率
D.若单位时间内生成2 molCO2的同时,消耗1mol SO2,则说明反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中加入A、B、C三种气体,保持温度一定,在t1~t4时刻测得各物质的浓度如表.据此判断下列结论正确的是( )
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol•L﹣1) | 6 | 3 | 2 | 2 |
| c(B)/(mol•L﹣1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol•L﹣1) | 1 | 2.5 | 3 | 3 |
|
| A. | 在t3时刻反应已经停止 |
|
| B. | A的转化率比B的转化率低 |
|
| C. | 该温度下此可逆反应平衡常数K=4 |
|
| D. | 该反应的化学方程式为2A(g)+B(g)⇌C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
NH3分子的空间构型是三角锥形,而不是正三角形的平面结构,其充分的理由是( )
A. NH3分子是非极性分子
B.分子内3个N—H键的键长相等,键角相等
C. NH3分子内3个N—H键的键长相等,3个键角都等于107°18′
D. NH3分子内3个N—H键的键长相等,3个键角都等于120°
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com