
工业上从4J29合金(铁钴镍合金)废料中提取钴和镍,一般先用硫酸溶解合金使之成为Fe2+、Co2+、Ni2+,再把Fe2+氧化为Fe3+,从而使Fe3+转化为某种沉淀析出,达到与Ni2+、Co2+分离的目的。生产上要使Fe2+氧化为Fe3+,而不使Co2+、Ni2+被氧化的试剂是NaClO或NaClO3(均含少量H2SO4)溶液,反应的部分化学方程式如下(A为还原剂):
NaClO+A+B―→NaCl+C+H2O
NaClO3+A+B―→NaCl+C+H2O
(1)请完成以上化学方程式:________________________________________,________________________________________________。
实际生产中采用NaClO3来氧化Fe2+比较合算,其理由是_________________ _____________________________________________________________________________________________________________________________。
(2)配平下列离子方程式,并回答问题。
 Fe(OH)3+
Fe(OH)3+ ClO-+
ClO-+ OH-===
OH-=== FeO
FeO +
+ Cl-+
Cl-+ H2O
H2O
(3)已知有3.21 g Fe(OH)3参加反应,共转移了5.418×1022个电子,则n=________。
(4)根据上述(2)(3)题推测FeO 能与下列哪些物质反应________(只填序号)。
能与下列哪些物质反应________(只填序号)。
A.Cl2 B.SO2
C.H2S D.O2
解析 (1)根据题干信息,A(或B)为FeSO4,B(或A)为H2SO4,根据电子守恒配平。因为NaClO3中氯元素的化合价为+5价,NaClO中氯元素的化合价为+1价,相同质量的两种物质,NaClO3能氧化更多的Fe2+。
(2)
 (OH)3+
(OH)3+
 O-+
O-+ OH-―→
OH-―→
 O
O +
+
 -+
-+ H2O,Fe的化合价升高5-n,氯的化合价降低2,根据得失电子守恒、电荷守恒、原子守恒,化学计量数依次为:2,5-n,2n,2,5-n,3+n。
H2O,Fe的化合价升高5-n,氯的化合价降低2,根据得失电子守恒、电荷守恒、原子守恒,化学计量数依次为:2,5-n,2n,2,5-n,3+n。
(3)电子转移数为 ×(5-n)×NA=5.418×1022,解得n=2。
×(5-n)×NA=5.418×1022,解得n=2。
(4)FeO 具有强氧化性,能氧化SO2、H2S等还原性物质。
具有强氧化性,能氧化SO2、H2S等还原性物质。
答案 (1)NaClO+2FeSO4+H2SO4===NaCl+Fe2(SO4)3+H2O
NaClO3+6FeSO4+3H2SO4===NaCl+3Fe2(SO4)3+3H2O
相同质量的NaClO3比NaClO能氧化更多的Fe2+
(2)2 5-n 2n 2 5-n 3+n
(3)2 (4)BC


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
下列图像能表示相关反应中生成物物质的量的变化的是(横、纵坐标单位:mol) ( )。
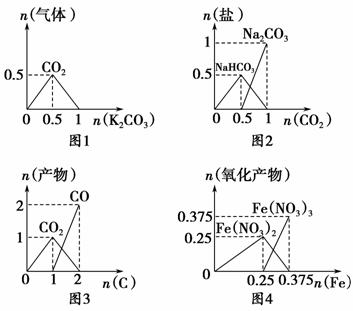
A.图1:n(HCl)=1 mol,K2CO3加入到HCl溶液中,在敞口容器中生成的气体
B.图2:n(NaOH)=1 mol,CO2通入到NaOH溶液中反应生成的盐
C.图3:n(O2)=1 mol,高温下C和O2在密闭容器中的生成物
D.图4:n(HNO3)=1 mol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有大量的Mg2+、Al3+、H+、Cl-和少量OH-,向该溶液中逐滴加入0.5 mol·L-1 NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积之间的关系如下图所示,则可判断原溶液中 ( )。
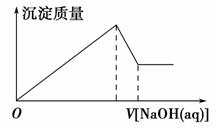
A.有Mg2+,没有Al3+ B.有Al3+,没有Mg2+
C.有Mg2+和Al3+ D.有大量的H+、Mg2+和Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。
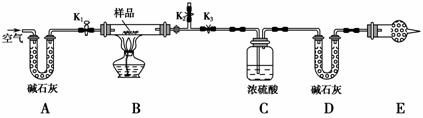
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是____________________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是______________________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________________________________________
____________________________________________________、
___________________________________________________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是______________________ _______________________________________________________。
②E处干燥管中盛放的药品是________,其作用是___________________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量分数________(填“偏大”、“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某含铬(Cr2O )废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到n mol FeO·FeyCrxO3,不考虑处理过程中的实际损耗,下列叙述错误的是 ( )。
)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到n mol FeO·FeyCrxO3,不考虑处理过程中的实际损耗,下列叙述错误的是 ( )。
A.消耗硫酸亚铁铵的物质的量为n(2-x)mol
B.处理废水中Cr2O 的物质的量为
的物质的量为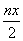 mol
mol
C.反应中发生转移的电子总物质的量为3nxmol
D.在FeO·FeyCrxO3中,3x=y
查看答案和解析>>
科目:高中化学 来源: 题型:
图1和图2是A、B两种物质的核磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图1和图2两种物质的核磁共振氢谱谱图选择出可能属于图1和图2的两种物质是( )


A.A是C3H6;B是C6H6 B.A是C2H6;B是C3H6
C.A是C2H6;B是C6H6 D.A是C3H6;B是C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
某气态化合物X含有C、H、O三种元素,现已知下列条件:①X中C的质量分数 ②X中H的质量分数 ③X在标准状况下的体积 ④X对氢气的相对密度 ⑤X的质量。欲确定该化合物的分子式,所需的最少条件是( )
A.①②④ B.②③④ C.①③⑤ D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
有Fe2+、NO—3、Fe3+、NH+4、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生 成物,下列叙述不正确的是
A.氧化剂与还原剂的物质的量之比为8:1
B.该过程说明Fe(NO—3)2溶液不宜加酸酸化
C.若有1 mol NO3发生还原反应,则转移8 mol e—
D.若把该反应设计为原电池,则负极反应为Fe2+一e—=Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应热的叙述正确的是 ( )
A.已知2H2(g)+O2(g) 2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热为-241.8kJ/mol
B.由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
C.X(g)+Y(g) Z(g)+W(s) △H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
Z(g)+W(s) △H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
D.已知C(s)+O2(g)=CO2(g) △H1 , C(s)+1/2O2(g)=CO(g) △H2,则△H1<△H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com