
【题目】下列图像与描述相符的是( )
A.图1是C(s)+H2O(g)![]() CO(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0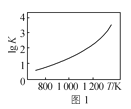
B.图2表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化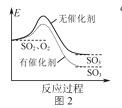
C.图3是室温下AgCl和AgI的饱和溶液中离子浓度的关系曲线,说明该温度下反应AgCl(s)+I-(aq)![]() AgI(s)+Cl-(aq)的平衡常数K=2.5×106
AgI(s)+Cl-(aq)的平衡常数K=2.5×106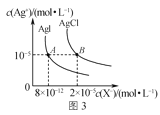
D.图4表示向BaCl2溶液中滴加稀硫酸至过量的过程中溶液导电性的变化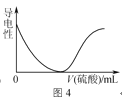
【答案】C
【解析】
A.图1是C(s)+H2O(g)![]() CO(g)+H2(g)的平衡常数与反应温度的关系曲线,升高温度平衡常数增大,正方向是吸热反应,说明该反应的ΔH>0,故A错误;
CO(g)+H2(g)的平衡常数与反应温度的关系曲线,升高温度平衡常数增大,正方向是吸热反应,说明该反应的ΔH>0,故A错误;
B.催化剂不能改变生成物的能量,可以降低反应的活化能,故B错误;
C. 根据图象,Ksp(AgCl)=2×10-5×10-5=2×10-10,根据图象,AgI的溶度积常数为Ksp(AgI)=8×10-12×10-5=8×10-17,反应为:AgCl(s)+I-(aq)![]() AgI(s)+Cl-(aq),在该温度下的平衡常数K=
AgI(s)+Cl-(aq),在该温度下的平衡常数K=![]() =
=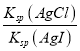 =
=![]() =2.5×106,故C正确;
=2.5×106,故C正确;
D.向BaCl2溶液中滴加稀硫酸至过量,可生成硫酸钡沉淀和盐酸,溶液导电性有所减弱,但不会接近0,图象曲线变化与实际不符,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面具有很好的应用前景。PPG的一种合成路线如图所示:
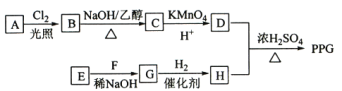
已知:①烃A的相对分子质量为70,其一氯代物只有一种;
②化合物B为单氯代烃;C的分子式为C5H8;
③E、F为相对分子质量差14的同系物;
④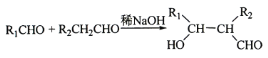 。
。
回答下列问题:
(1)A的结构简式为__________________。
(2)由B生成C的化学方程式为_____________________________________________________。
(3)C的化学名称为___________________,由E和F生成G的反应类型为___________________。由D和H生成PPG的化学方程式为_________________________________。
(4)请写出两种D的同分异构体中能同时满足下列条件的结构简式___________、__________:
①能与饱和NaHCO3溶液反应产生气体;②既能发生银镜反应,又能发生水解反应;
(5)写出以分子式为C5H8的烃为主要原料,制备有机物M( )的合成路线流程图(无机试剂任选)。
)的合成路线流程图(无机试剂任选)。
(合成路线常用的表示方式为:![]() )________________
)________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种含酰亚胺结构的对苯二胺衍生物的合成路线,其产物(F)可作为一种空腔孔径较大的新型大环芳酰胺的合成原料。
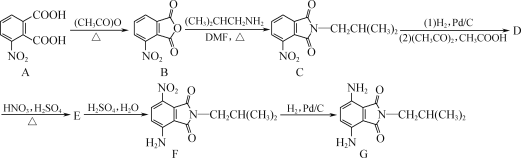
(1)A中官能团的名称为________和________。
(2)F→G的反应类型为________。
(3)D的分子式为C14H16N2O3,写出D的结构简式:________。
(4)A的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;
②含有苯环,且苯环上含有硝基;
③含有三种不同化学环境的氢原子。
(5)写出以甲苯、邻二甲苯,制备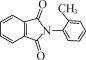 (无机试剂和DMF,(CH3CO)2O及有机溶剂任用,合成路线流程图示例见本题题干)________。
(无机试剂和DMF,(CH3CO)2O及有机溶剂任用,合成路线流程图示例见本题题干)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O=Na++2OH+H2↑
B.澄清石灰水与少量小苏打溶液混合:Ca2+ + OH-+ HCO3-=CaCO3↓+ H2O
C.向沸水中滴入适量的饱和氯化铁溶液;Fe 3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D.碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3-+ OH-=CO32-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍及化合物在机械制造、磁性材料、新型电池或高效催化剂等许多领域都有着广泛的应用。请回答下列问题:
(1)基态Ni原子核外的最高能层符号是______,基态Ni2+最外层电子排布式为_______,未成对电子数为________________。
(2)[Co(NO![]() )4]2–中各元素的第一电离能由小到大的顺序为______(填元素符号),配体中N的杂化方式为______________。
)4]2–中各元素的第一电离能由小到大的顺序为______(填元素符号),配体中N的杂化方式为______________。
(3)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如图所示:
①上述三种晶体的晶胞中属于体心立方晶胞的是______(填“α”“δ”或“γ”)-Fe。
②γ-Fe晶胞中铁原子的配位数为_______________。
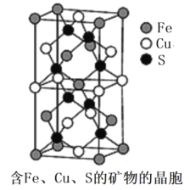
(4)一种含有Fe、Cu、S 三种元素的矿物的晶胞(如图所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为_________。若晶胞的底面边长为Apm,高为C pm,阿伏伽德罗常数为NA,则该晶体的密度为__________g/cm3(写出表达式)。
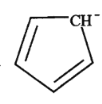
(5)二茂铁[(C5H5)2Fe]可用作火箭燃料添加剂、汽油抗爆剂。二茂铁熔点172℃,沸点249℃,易升华,难溶于水,易溶于有机溶剂,它属于__________晶体。分子中的大π键可用符号![]() 表示,其m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,环戊二烯负离子(C5H
表示,其m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,环戊二烯负离子(C5H![]() )结构如图所示,其中的大π键可以表示为_______。
)结构如图所示,其中的大π键可以表示为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的ΔH>0,ΔS<0
B.常温下,将稀CH3COOH溶液加水稀释,溶液中![]() 的值不变
的值不变
C.在铜的精炼过程中,若转移1mol电子,则阴极析出Cu的质量为32g
D.一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,则其热化学方程式为N2(g)+3H2(g)=2NH3(g);ΔH=-38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的恒容容器中,用CO2和H2合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。将1molCO2和3molH2在反应器中反应8小时,CH3OH的产率与温度的关系如图所示。下列说法正确的是( )
CH3OH(g)+H2O(g)。将1molCO2和3molH2在反应器中反应8小时,CH3OH的产率与温度的关系如图所示。下列说法正确的是( )
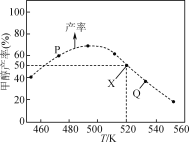
A.反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH>0
CH3OH(g)+H2O(g)的ΔH>0
B.图中P点所示条件下,延长反应时间能提高CH3OH的产率
C.图中Q点所示条件下,增加CO2的浓度可提高H2的转化率
D.520K时,反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的平衡常数K=
CH3OH(g)+H2O(g)的平衡常数K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种常见气体单质。E的相对分子质量比F小16,且F为红棕色。有关的转化关系如图所示(反应条件与部分反应的生成物略去)。
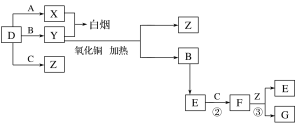
请回答下列问题:
(1)D的化学式为__,Y的化学式为__,E的化学式为__。
(2)Y与氧化铜反应,每生成1molB消耗3mol氧化铜,该反应的化学方程式为__。
(3)Y与E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为__。
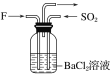
(4)气体F和气体SO2在通常条件下同时通入盛有BaCl2溶液的洗气瓶中(如图所示),洗气瓶中是否有沉淀生成?__,理由是__。
【答案】H2 NH3 NO 2NH3+3CuO![]() N2+3Cu+3H2O 6NO+4NH3
N2+3Cu+3H2O 6NO+4NH3![]() 5N2+6H2O 有 二氧化氮与水反应生成硝酸,硝酸可将二氧化硫或亚硫酸氧化成硫酸,硫酸与氯化钡反应可生成硫酸钡沉淀
5N2+6H2O 有 二氧化氮与水反应生成硝酸,硝酸可将二氧化硫或亚硫酸氧化成硫酸,硫酸与氯化钡反应可生成硫酸钡沉淀
【解析】
A、B、C、D是四种常见气体单质.E的相对分子量比F的小16,且F为红棕色,可推知F为NO2,E为NO,C为O2,B为N2,结合转化关系,气体单质D、A反应得到X,气体单质D与B反应得到Y,X与Y反应冒白烟,应是氨气与HCl反应,可推知D为氢气、A为氯气、X为HCl、Y为氨气,D与C反应生成Z为水,F与Z反应生成G为HNO3,据此解答。
A、B、C、D是四种常见气体单质.E的相对分子量比F的小16,且F为红棕色,可推知F为NO2,E为NO,C为O2,B为N2,结合转化关系,气体单质D、A反应得到X,气体单质D与B反应得到Y,X与Y反应冒白烟,应是氨气与HCl反应,可推知D为氢气、A为氯气、X为HCl、Y为氨气,D与C反应生成Z为水,F与Z反应生成G为HNO3;
(1)由上述分析可知,D的化学式为H2,Y的化学式为NH3,E的化学式为NO;
(2)NH3与氧化铜反应,每生成1molN2消耗3mol氧化铜,还原产物中Cu应是化合价为a,则:3(2-a)=2×3,解得a=0,故生成Cu,该反应的化学方程式为:2NH3+3CuO ![]() N2+3Cu+3H2O;
N2+3Cu+3H2O;
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为4NH3+6NO ![]() 5N2+6H2O;
5N2+6H2O;
(4)二氧化氮与水反应生成硝酸,硝酸可将二氧化硫或亚硫酸氧化成硫酸,硫酸与氯化钡反应可生成硫酸钡沉淀,故气体NO2和气体SO2在通常条件下同时通入盛有BaCl2溶液的洗气瓶中,洗瓶中有沉淀生成。
【题型】推断题
【结束】
20
【题目】硝酸是一种重要的化工原料,用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取含硝基的炸药等。试回答下列问题:
(1)某同学对铁与稀硝酸的反应进行探究,若HNO3只被还原成NO,则:
①写出铁与过量稀硝酸反应的离子方程式:__。
②写出过量铁与稀硝酸反应的离子方程式:__。
③若28g铁与含1.6mol硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比为__。上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为__g。
(2)饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:__Al+__NO3-+__OH-+__=__[Al(OH)4]-+__N2↑。
②上述反应中,还原剂与还原产物的物质的量之比是__,反应中转移电子0.3mol,生成__mL(标准状况下)N2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:

为了研究X的结构,将化合物A在一定条件下水解只得到 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com