
| A. | 原子半径:X<Y<Z<W | |
| B. | 气态氢化物的稳定性:Y>Z>W | |
| C. | Y、Z、W均可与Mg形成离子化合物 | |
| D. | 最高价氧化物对应水化物的酸性:Y>Z |
分析 X、Y、Z、W为短周期元素,X的M电子层有1个电子,则X为Na;Y的最外层电子数为内层电子数的2倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,故Y为C元素;Z的最高化合价为最低化合价绝对值的3倍,处于VIA族,由于氧元素没有+6价,则Z为S元素,Z与W同周期,W的原子半径小于Z,则W为Cl.
解答 解:X、Y、Z、W为短周期元素,X的M电子层有1个电子,则X为Na;Y的最外层电子数为内层电子数的2倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,故Y为C元素;Z的最高化合价为最低化合价绝对值的3倍,处于VIA族,由于氧元素没有+6价,则Z为S元素,Z与W同周期,W的原子半径小于Z,则W为Cl.
A.同周期自左而右原子半径减小,一般电子层越多原子半径越大,故原子半径:Y(C)<W(Cl)<Z(S)<X(Na),故A错误;
B.非金属性W(Cl)>Z(S)>Y(C),故气态氢化物的稳定性:W>Z>Y,故B错误;
C.Y、Z、W与Mg分别可以形成MgC2、MgS、MgCl2,三种都是离子化合物,故C正确;
D.Y、Z最高价氧化物对应水化物分别为碳酸、硫酸,碳酸是弱酸,而硫酸为强酸,故D错误.
故选:C.
点评 本题考查结构性质位置关系应用,侧重对元素周期律的考查,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
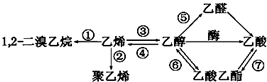
| A. | 反应①③是加成反应 | B. | 反应②是加聚反应 | ||
| C. | 只有反应⑦是取代反应 | D. | 反应④是消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向葡萄糖溶液中加入足量NaOH溶液后,再加入新制氢氧化铜悬浊液,加热,可观察到产生黑色沉淀 | |
| B. | 向米汤中加入含碘的食盐,观察是否有颜色的变化,检验含碘食盐中是否含碘酸钾 | |
| C. | 向淀粉溶液中加入稀硫酸,加热后再用NaOH溶液中和并做银镜反应实验,检验淀粉是否水解 | |
| D. | 向油脂中加入NaOH溶液再蒸馏,提纯油脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
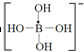 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
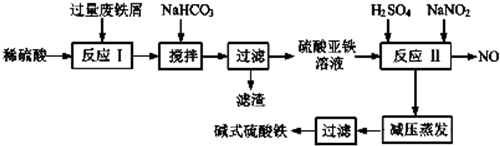
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.0 | 4.4 |
| 实验操作 | 现象 | 结论 |
| 取适量产品于洁净烧杯中,加入适量蒸馏水,充分搅拌,静置,滤去沉淀 | 得红棕色溶液 | 溶液中含有Fe3+ |
| 取少量溶液于试管中,滴加0.05mol/L的酸性高锰酸钾溶液 | 溶液不褪色 | 溶液中不含Fe2+ |
| 取少量溶液于试管中,滴加0.1mol/L的氯化钡溶液,再加入20%稀硝酸溶液 | 有白色沉淀 | 溶液中含有SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
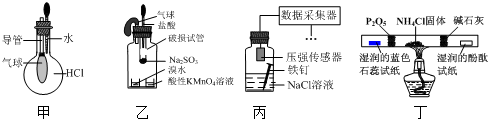
| A. | 用装置甲验证HCl气体易溶于水 | |
| B. | 用装置乙验证SO2具有漂白性 | |
| C. | 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀 | |
| D. | 用装置丁检验NH4Cl分解产生的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
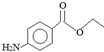
| A. | M分子式为C8H11NO2 | |
| B. | 1mol M与NaOH溶液反应消耗1mol NaOH | |
| C. | M与盐酸的反应属于加成反应 | |
| D. | 与M含有相同官能团的同分异构体有8种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com