
【题目】某有机物的结构简式如图,下列说法不正确的是
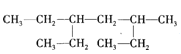
A.该有机物属于饱和链烃
B.该烃的名称是2,4-二乙基己烷
C.该烃与2,5-二甲基-3-乙基己烷互为同分异构体
D.该烃的一氯代物共有8种
【答案】B
【解析】
A.饱和烃分子中只含有单键,不存在不饱和键;
B.该有机物为烷烃,根据烷烃的命名原则对该有机物进行命名;
C.两种有机物的分子式相同、结构不同,二者互为同分异构体;
D.根据有机物分子中含有等效氢原子的数目进行判断.
A.该有机物分子中含有的化学键全部是单键,所以该有机物属于饱和烃,故A正确;
B.CH3CH2CH(C2H5)CH2CH(CH3)CH2CH3分子中,最长碳链含有7个C,主链为庚烷,在3号C含有1个甲基,在5号C原子含有1个乙基,该有机物命名为:3一甲基一5一乙基庚烷,故B错误;
C.2,5一二甲基一3一乙基己烷为含有10个C原子烷烃,CH3CH2CH(C2H5)CH2CH(CH3)CH2CH3分子也是含有10个C烷烃,这两种有机物结构不同,所以二者互为同分异构体,故C正确;
D.CH3CH2CH(C2H5)CH2CH(CH3)CH2CH3分子中 ,两个乙基对称,乙基中含有2种等效H,其它6个C原子总共含有6种等效氢原子,所以其分子中含有8种等效H原子,其一氯代物有8种同分异构体,故D正确;
故选B.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】四氢铝锂(LiAlH4)常作为有机合成的重要还原剂。工业上以辉锂矿(主要成分是LiAlSi2O6,含少量Fe2O3)为原料合成四氢铝锂的流程如图:
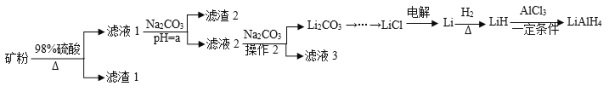
已知:金属氢氧化物沉淀的pH如下表所示:
物质 | Fe(OH)3 | Al(OH)3 |
开始沉淀的pH | 2.3 | 4 |
完全沉淀的pH | 3.7 | 6.5 |
请回答:
(1)写出LiAlSi2O6与硫酸反应的化学方程式__。滤渣2的主要成分为__(填化学式),“a”的最小值为__。
(2)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系如下表所示。操作2中,蒸发浓缩后必须趁热过滤,其原因是__,90℃时Ksp(Li2CO3)的值为__。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/mol·L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(3)流程中由LiC1制备金属Li的电解条件是__。
(4)为测定制备的四氢铝锂(LiAlH4)的纯度,称取样品ag加入水使其完全反应后,收集到标况下气体VmL,
①LiAlH4溶解时发生反应的化学方程式为__。
②样品的纯度为__(列出数学表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,等物质的量的N2和CO所含分子数均为NA
B.将含0.l mol FeCl3的饱和溶液制成胶体后,生成的Fe(OH)3胶粒数目为0.1NA
C.常温常压下,lmolNa 加热后生成的Na2O、Na2O2混合物中阴离子数目一定为0.5NA
D.1molFe与足量水蒸气在高温下充分反应后失电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生命活动密切相关。以下是人体中血红蛋白、肌红蛋白与O2结合机制的相关研究,假定其环境温度均为36.8℃。
(1)血红蛋白Hb结合O2形成动脉血,存在反应①:HbH+(aq)+O2(g)![]() HbO2(aq)+H+(aq)。该反应可自发进行,则其ΔH______0(填“>”或“<”);血液中还同时存在反应②:CO2+H2O
HbO2(aq)+H+(aq)。该反应可自发进行,则其ΔH______0(填“>”或“<”);血液中还同时存在反应②:CO2+H2O![]() H++HCO3-,结合反应①②,肺部氧分压_____(填“较高”或“较低”)有利于CO2排出体外,从化学平衡角度解释原因 ____________。
H++HCO3-,结合反应①②,肺部氧分压_____(填“较高”或“较低”)有利于CO2排出体外,从化学平衡角度解释原因 ____________。
(2)肌肉中大量肌红蛋白 Mb也可结合O2形成MbO2,即反应③:Mb(aq)+O2(g)![]() MbO2(aq),其平衡常数K=
MbO2(aq),其平衡常数K=![]() 。其它条件不变,随着氧分压p(O2)增大,K值___(填“变大”、“变小”或“不变”)。已知在氧分压p(O2)=2.00 kPa 的平衡体系中,
。其它条件不变,随着氧分压p(O2)增大,K值___(填“变大”、“变小”或“不变”)。已知在氧分压p(O2)=2.00 kPa 的平衡体系中,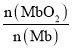 =4.0。吸入的空气中p(O2)=21 kPa,计算此时 Mb与氧气的最大结合度(平衡转化率)约为_______________(保留两位有效数字)。
=4.0。吸入的空气中p(O2)=21 kPa,计算此时 Mb与氧气的最大结合度(平衡转化率)约为_______________(保留两位有效数字)。
(3)Hb分子具有四个亚基,且每个亚基有两种构型(T型和R型)。图中,T0、R0表示未结合O2的T型和R型,且存在可逆的变构效应:T0![]() R0,正向平衡常数为K0;当四分子O2与Hb的四个亚基结合后,T4
R0,正向平衡常数为K0;当四分子O2与Hb的四个亚基结合后,T4![]() R4也是变构效应,正向平衡常数为K4。
R4也是变构效应,正向平衡常数为K4。
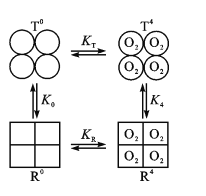
①已知某肺炎病人肺脏中T0+4O2![]() T4反应的n(O2)数据如下:
T4反应的n(O2)数据如下:
t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(O2)/10-6 mol | 1.68 | 1.64 | 1.58 | 1.50 | 1.40 |
计算2.0 min~8.0 min内以T的物质的量变化表示的反应速率v(T4)为_________mol·min-1。
②现假定R型Hb对O2的结合常数为KR,T型Hb对O2的结合常数为KT。已知KR>KT,则图中K0____K4(填“>”或“<”)。
(4)氧气是生命活动必不可少的物质。如下图所示,以Pt为阳极,Pb(CO2)的载体,使CO2活化为阴极,电解经CO2饱和处理的KHCO3溶液可使氧气再生,同时得到甲醇。其阴极反应式为____;从电解后溶液中分离甲醇的操作方法是_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
1 | ① | |||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ② | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表中元素⑩的氢化物的电子式为___,此氢化物的还原性比元素⑨的氢化物__(强或弱),请用一个化学方程式证明这一事实___。
(2)分别写出⑧⑨⑩最高价氧化物对应的水化物的化学式___,并比较其酸性的强弱__
(3)能生成两性氢氧化物的元素是___,其最高价氧化物的水化物电离方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X与W同主族,Y原子的最外层电子数是其内层电子数的3倍,0.1 mol Z单质与足量盐酸反应产生H2的体积为3.36 L(折算成标准状况),W在元素周期表中的主族序数比其周期数大1。下列说法正确的是( )
A.XY2属于离子化合物
B.X的一种单质在高温下与WY2反应可制得W单质
C.原子半径:r(Z)>r(W)>r(Y)>r(X)
D.W的简单气态氢化物的热稳定性比Y的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是
A. KClO3在反应中得到电子 B. ClO2是还原产物
C. H2C2O4发生氧化反应 D. 1 molKClO3参加反应有2mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染物主要成分是SO2、NO2、NO、CO及可吸入颗粒等,主要来自于燃煤、机动车尾气和工业废气,会导致雾霾、酸雨等。
(1)汽车的三元催化转化器中,在催化剂作用下NO和CO转化为无毒气体,反应的化学方程式是: 2CO+2NO ![]() 2CO2+N2,该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式),当生成2mol N2时,转移电子的物质的量是____________________。
2CO2+N2,该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式),当生成2mol N2时,转移电子的物质的量是____________________。
(2)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的pH=5.5,将烟气中的SO2转化为SO42―。已知0.1mol/L 100mLNaClO溶液,可以恰好吸收0.01moL SO2,则反应的离子方程式是______________________。
(3)SO2通过如图过程既能制得H2SO4又能制得H2。图中可循环利用的物质X是_________(填化学式),制得H2SO4的化学方程式是__________________________。

(4)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:NO2+NO+2NaOH===2NaNO2+H2O 2NO2+2NaOH===NaNO2+NaNO3+H2O
现有V L某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。所用烧碱溶液的物质的量浓度至少为________ mol·L1。若所得溶液中c(![]() )∶c(
)∶c(![]() )=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=____________________。
)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com