
下列与有机物的结构、性质有关的叙述正确的是( )
A.苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应
B.石油的主要成分是烃,煤经过分馏可制得焦炭、煤焦油等产品
C.丙烯分子中所有原子不可能在同一平面上
D.淀粉、纤维素都是天然高分子有机物,其链节中都含有葡萄糖
科目:高中化学 来源:2014年高考化学鲁科版2.1元素与物质的分类练习卷(解析版) 题型:填空题
无机化合物可根据其组成和性质进行分类。
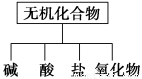
(1)如图所示的物质分类方法是 。
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
物质类别 | 酸 | 碱 | 盐 |
氧化物 |
化学式 | ①HCl② | ③ ④Ba(OH)2 | ⑤Na2CO3⑥ | ⑦CO2 ⑧Na2O2 |
(3)写出⑦转化为⑤的化学方程式: 。
(4)呼吸面具中用⑧作为O2来源的反应原理为: 。
(5)实验室制备⑦常用 和 反应,检验该气体的方法是 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学题型冲刺练习 突破离子反应的三个角度(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.澄清透明的溶液中:Na+、K+、MnO4-、AlO2-
B.0.1 mol·L-1 FeCl3溶液中:K+、NH4+、I-、SCN-
C.c(OH-)/c(H+)=1012的溶液中:SO32-、NH4+、ClO-、K+
D.能溶解Al2O3的溶液中:Na+、K+、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学题型冲刺练习 有机物的组成、结构与性质(解析版) 题型:选择题
下列有关同分异构体数目的叙述中,正确的是( )
A.戊烷有2种同分异构体
B.C8H10中只有3种属于芳香烃的同分异构体
C.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
D.CH3CH2CH2CH3光照下与氯气反应,只生成1种一氯代烃
查看答案和解析>>
科目:高中化学 来源:2014年高考化学题型冲刺练习 基础实验题(解析版) 题型:选择题
下图所示的实验装置中,不能达到实验目的的是( )
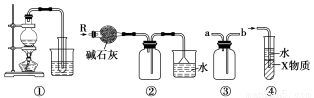
A.装置①可制取少量蒸馏水
B.装置②可用于干燥、收集氨气,并吸收多余的氨气
C.装置③可用于排空气法收集H2、CO2、Cl2、HCl、NO等气体
D.装置④中X物质若为四氯化碳,则可用于吸收氨气或氯化氢
查看答案和解析>>
科目:高中化学 来源:2014年高考化学题型冲刺练习 基础实验题(解析版) 题型:选择题
下列有关实验操作与结论都正确的是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某钠盐中加入稀盐酸,产生能使澄清石灰水变浑浊的气体 | 说明该盐一定是碳酸盐 |
B | 向某无色溶液中滴加NaOH溶液,先产生白色沉淀,后沉淀又会全部消失 | 该无色溶液中一定有Al3+,无Mg2+ |
C | 向尿液中加入新制Cu(OH)2,没有砖红色沉淀生成 | 说明尿液中不含有葡萄糖 |
D | 某待测液中先滴入氯水无明显现象,后滴入硫氰化钾溶液出现血红色 | 该待测液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源:2014年高考化学题型冲刺练习 化学基本概念、解决化学与STSE问题(解析版) 题型:选择题
判断下列有关化学基本概念的依据不正确的是( )
A.溶液与胶体:能否发生丁达尔效应
B.氧化还原反应:元素化合价是否变化
C.强弱电解质:在水溶液或熔融状态下能否完全电离
D.共价化合物:是否含有共价键
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习专练4 无机化工流程题专项突破练习卷(解析版) 题型:填空题
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
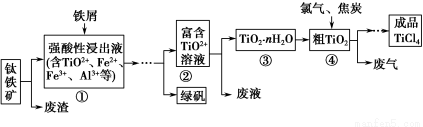
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+??Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用 方法。
| TiCl4 | SiCl4 |
熔点/℃ | -25.0 | -68.8 |
沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com