

分析 I.(1)过氧化氢中H-O原子之间、O-O原子之间都存在一对共用电子对;
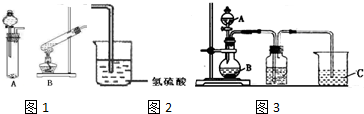
(2)用过氧化氢的水溶液和二氧化锰制备氧气,反应物状态为固液混合,且不需要加热;有连接的装置在使用前必须检验装置气密性;
(3)元素的非金属性越强,其单质的氧化性越强;
(4)元素的非金属性越强,该元素得电子能力越强,其单质的氧化性越强,其简单阴离子的还原性越弱,其单质与氢气反应越容易,其氢化物的稳定性越强,其最高价氧化物的水化物酸性越强;
II.(5)元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,A是一种强酸,常温下可与铜反应,则A应该是N元素最高价氧化物的水化物硝酸;B是难溶性块状固体,能和硝酸反应,为碳酸钙;打开分液漏斗的活塞后,C中可观察到白色沉淀生成,C中溶液应该是硅酸钠溶液.
解答 解:I.(1)过氧化氢中H-O原子之间、O-O原子之间都存在一对共用电子对,其电子式为 ,故答案为:
,故答案为: ;
;
(2)用过氧化氢的水溶液和二氧化锰制备氧气,反应物状态为固液混合,且不需要加热,所以应该选择A装置;有连接的装置在使用前必须检验装置气密性,所以该实验之前必须检验装置气密性,否则收集不到气体,
故答案为:A;检验装置气密性;
(3)元素的非金属性越强,其单质的氧化性越强,氧气能氧化硫化氢生成S而说明O元素的非金属性大于S,反应方程式为O2+2H2S=2S↓+2H2O,故答案为:O2+2H2S=2S↓+2H2O;
(4)元素的非金属性越强,该元素得电子能力越强,其单质的氧化性越强,其简单阴离子的还原性越弱,其单质与氢气反应越容易,其氢化物的稳定性越强,其最高价氧化物的水化物酸性越强,
a.H2S的酸性弱于HCl,说明硫化氢的电离程度大于HCl,但不能证明非金属性强弱,故错误;
b.元素的非金属性越强,其简单阴离子的还原性越弱,S2-的还原性强于Cl-,说明非金属性Cl大于S元素,故正确;
c.S在常温下为固体而Cl2为气体与非金属性强弱无关,故错误;
d.H2SO3的酸性弱于HClO3,这两种酸都不是其对应的最高价氧化物的水化物,所以不能判断非金属性强弱,故错误;
e.元素的非金属性越强,其氢化物的稳定性越强,H2S不如HCl稳定,则非金属性Cl>S,故正确;
f.元素的非金属性越强,其单质与氢气化合越容易,S与H2化合不如Cl2与H2化合剧烈,则非金属性Cl>S,故正确;
故选bef;
II.(5)元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,A是一种强酸,常温下可与铜反应,则A应该是N元素最高价氧化物的水化物硝酸;B是难溶性块状固体,能和硝酸反应,为碳酸钙;打开分液漏斗的活塞后,C中可观察到白色沉淀生成,C中溶液应该是硅酸钠溶液,
该实验是利用硝酸和碳酸钙反应制取二氧化碳,因为硝酸具有挥发性,所以生成的二氧化碳中含有硝酸,用饱和的碳酸氢钠除去二氧化碳中的硝酸,则洗气瓶中液体是碳酸氢钠,二氧化碳、水和硅酸钠反应生成难溶性的硅酸,从而判断非金属性强弱,
故答案为:HNO3;CaCO3;Na2SiO3.
点评 本题考查性质实验方案设计,为高频考点,明确实验原理、物质性质是解本题关键,会根据元素周期律判断非金属性强弱,易错点是(4)题d选项及实验装置仪器选择,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 溶液pH≤2时,生铁发生吸氧腐蚀 | |
| B. | 在酸性溶液中生铁只能发生析氢腐蚀 | |
| C. | 析氢腐蚀和吸氧腐蚀的速率一样快 | |
| D. | 两溶液中负极反应均为Fe-2e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
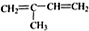 ⑤
⑤
 .
. D.
D.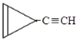 ,其中A、B是链状分子(不考虑这些结构能否稳定存在),请写出所有碳原子均共线的一种链状分子的结构简式:CH≡C-C≡C-CH3.
,其中A、B是链状分子(不考虑这些结构能否稳定存在),请写出所有碳原子均共线的一种链状分子的结构简式:CH≡C-C≡C-CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2OH | B. | (CH3)3CCH2OH | C. | HOCH2CHBrCH3 | D. | CH3OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol H2O2完全分解转移的电子数为0.4 NA | |
| B. | 1L密度为1.84g•cm-3质量分数为98%的硫酸溶液中,所含氢原子数为36.8NA | |
| C. | 在常温常压下,2.24 L SO2与O2混合气体中所含氧原子数为0.2 NA | |
| D. | 在标准状况下,2.8 g N2和2.8 g CO所含电子数均为1.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的有效成分是氯酸钙 | |
| B. | 将过量铁粉加入稀硝酸中,有气体生成,充分反应后滴加KSCN溶液,溶液呈血红色 | |
| C. | 将铜粉加1.0mol•L-1Fe2(SO4)3溶液中,溶液变蓝、有黑色固体出现 | |
| D. | 二氧化硅是制造光导纤维的材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
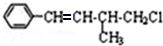
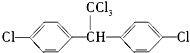
| A. | 1mol 该有机物在加热和催化剂作用下,最多能和3.5molH2反应 | |
| B. | 该有机物分子式为C11H15Cl | |
| C. | 该有机物遇硝酸银溶液产生白色沉淀 | |
| D. | 该有机物能通过消去、加成、水解三步反应生成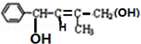 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
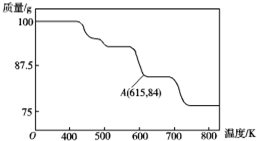 铬(Cr)有许多种化合物,在工业生产中有广泛的用途.
铬(Cr)有许多种化合物,在工业生产中有广泛的用途.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com