
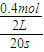 =0.01mol/L?s;
=0.01mol/L?s;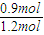 ×100%=75%.A是恒容反应容器,B是恒压反应容器.B容器充入1.2molCH3OH(g) 和2.4molH2O(g)与B容器充入1molCH2OH(g)和2molH2O(g),是等效平衡.反应方程式中生成物气体增多,反应时A容器压强比B容器大,所以A中平衡时相当于B平衡后的加压,加压平衡向逆反应方向移动,A容器中H2O百分含量增多,填B“<A”;
×100%=75%.A是恒容反应容器,B是恒压反应容器.B容器充入1.2molCH3OH(g) 和2.4molH2O(g)与B容器充入1molCH2OH(g)和2molH2O(g),是等效平衡.反应方程式中生成物气体增多,反应时A容器压强比B容器大,所以A中平衡时相当于B平衡后的加压,加压平衡向逆反应方向移动,A容器中H2O百分含量增多,填B“<A”;

 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
 (2009?丹东模拟)甲醇可以与水蒸气反应生成氢气,反应方程式如下:
(2009?丹东模拟)甲醇可以与水蒸气反应生成氢气,反应方程式如下:查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省赣州市六校高三上学期期末联考理综化学试卷(解析版) 题型:填空题
Ⅰ已知在常温常压下:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)?? △H=_1275.6kJ?mol-1
②H2O(l)═H2O(g)?? △H=+44.0kJ?mol-1写出表示甲醇燃烧热的热化学方程式:??????????????? 。
Ⅱ.甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g) + H2O(g)  CO2(g) + 3H2(g) ;△H>0
CO2(g) + 3H2(g) ;△H>0
(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为 ???? 。
(2)判断 ⑴ 中可逆反应达到平衡状态的依据是(填序号) ??????????? 。
①v正(CH3OH) = 3v逆(H2) ? ②混合气体的密度不变 ③混合气体的平均相对分子质量不变?????? ④CH3OH、H2O、CO2、H2的浓度都不再发生变化???? ⑤CO2和H2的浓度之比为1:3
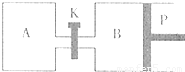
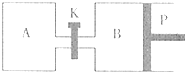
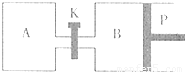
(3)图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述反应。? 已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。

Ⅲ.如图甲、乙是电化学实验装置。请回答下列问题:

(1)若两池中均盛放CuSO4溶液
①甲池中石墨棒上的电极反应式为____________________.
②如果起始时乙池盛有200mL CuSO4溶液,电解一段时间后溶液蓝色变浅,若要使溶液恢复到电解前的状态,需要向溶液中加入0.8g CuO,则其电解后的pH为????? (忽略溶液体积的变化)。
(2)若甲池中盛放饱和NaCl溶液,则甲池中石墨棒上的电极反应式为__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(13分) 工业原料甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) △H > 0
CO2(g)+3H2(g) △H > 0
(1)一定条件下,向体积为2 L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),20 s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示的反应速率 。
(2)右图中P是可自由平行滑动的活塞,关闭K,在相同温度下,向A容器中充入1 mol CH3OH和2 mol H2O(g),向B容器中充入1.2 mol CH3OH(g)和2.4 mol H2O(g),两容器分别发生上述反应。已知,起始时容器A和B的体积均为a L。试回答:

① 反应达到平衡时,容器B的体积为1.5 a L,B容器中CH3OH转化率为 ,A、B两容器中H2O(g)的体积百分含量的大小关系为B A(填“>”、“<”、“=” )
② 若打开K,一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。
(3)下面四个选项是四位学生在学习化学反应速率与化学反应限度以后,联系化工生产实际所发表的看法,你认为不正确的是_______
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
(4)甲醇等有机物在空气中燃烧时由于燃烧不充分可能会产生CO等污染物。有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:________________。
查看答案和解析>>
科目:高中化学 来源:2009年江苏省宿迁市高考化学冲刺试卷(二)(解析版) 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g);△H>0
CO2(g)+3H2(g);△H>0
(1)一定条件下,向体积为2L的恒容器密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为 。
(2)判断(1)中可逆反应达到平衡状态的依据是(填序号) 。
①v正(CH3OH)=v正(CO2)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
|
在相同温度时,向A容器中充入1molCH2OH(g)
和2molH2O(g),向B容器中充入1.2molCH3OH(g)
和2.4molH2O(g),两容器分别发生上述反应。
已知起始时容器A和B的体积均为aL。试回答:
①反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为 A、B两容器中H2O(g)的体积百分含量的大小关系为:B(填“>”、“<”、“=”) A。
②若打开K,一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com