
| 选项 | X气体 | Y溶液 | 预测的现象 |
| ① | CO2 | BaCl2溶液 | 白色沉淀析出 |
| ② | SO2 | Ba(N03)2溶液 | 白色沉淀析出 |
| ③ | Cl2 | AgNO3溶液 | 白色沉淀析出 |
| ④ | NH3 | AlCl3溶液 | 白色沉淀析出 |
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
分析 ①氯化钡溶液不与二氧化碳反应;
②SO2通入水中生成H2SO3,溶液呈酸性,NO3-在酸性条件下具有强氧化性,可与H2SO3发生氧化还原反应生成SO42-;
③氯气通入水中和水反应生成盐酸和次氯酸,氯离子和银离子反应生成氯化银沉淀;
④氨气溶于水生成一水合氨,一水合氨和氯化铝反应生成白色的氢氧化铝沉淀;
解答 解:①二氧化碳和氯化钡溶液不发生反应,则不会出现白色沉淀,故①错误;
②SO2通入水中生成H2SO3,溶液呈酸性,NO3-在酸性条件下具有强氧化性,可发生反应:3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+4H++2NO↑,会出现白色沉淀析出,故②正确;
③氯气与水反应:Cl2+H2O=H++Cl-+HClO,氯离子和银离子发生反应:Ag++Cl-+=AgCl↓,则会析出白色沉淀,故③正确;
④氨水是弱碱,不能溶解氢氧化铝,氯化铝溶液加入过量氨水的反应方程式为:AlCl3+3NH3•H2O═Al(OH)3↓+3NH4Cl,会出现白色沉淀析出,故④正确;
故选D.
点评 本题主要考查了参加气体的性质及检验方法,题目难度中等,明确常见气体的性质为解答关键,注意NO3-在酸性条件下具有强氧化性,试题培养了学生的灵活应用能力.


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题
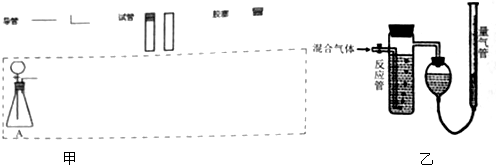
| 仪器标号 | 仪器中所加物质 | 作用 |
| A | 亚硫酸钠、浓硫酸 | 产生SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCO3能与盐酸反应,可用于治疗胃酸过多 | |
| B. | N2与O2在放电时生成NO,此反应用于工业制硝酸 | |
| C. | Al2O3熔点高,可用作耐高温材料 | |
| D. | 氢氟酸具有酸性,可用于雕刻玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 二氧化硫通入次氯酸钠溶液:SO2+ClO-+OH-=SO42-+Cl-+H2O | |
| C. | 硫酸工业尾气中的SO2用过量的氨水吸收:2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| D. | Cu溶于浓HNO3:Cu+4H++2NO3-=Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
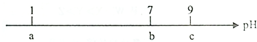 常温下,向10mL 0.1mol•L-1的HCl溶液中逐滴加入0.1mol•L-1的NH3•H2O溶液,其pH逐渐增大,图中a,b,c三点的pH为实验所测得.下列有关说法中一定错误的是( )
常温下,向10mL 0.1mol•L-1的HCl溶液中逐滴加入0.1mol•L-1的NH3•H2O溶液,其pH逐渐增大,图中a,b,c三点的pH为实验所测得.下列有关说法中一定错误的是( )| A. | 水的电离程度先增大后减小 | |
| B. | 当pH=7时,所加NH3•H2O溶液的体积大于10mL | |
| C. | 当7<pH<9时,溶液中c(NH4+)>c(Cl-) | |
| D. | 继续滴加0.1mol•L-1的NH3•H2O溶液,溶液的pH最终可以变化至13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com