


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
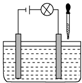 在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液时,则灯光由亮变暗至熄灭后又逐渐变亮的是( )
在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液时,则灯光由亮变暗至熄灭后又逐渐变亮的是( )| A、盐酸中逐滴加入食盐溶液 |
| B、醋酸中逐滴加入氢氧化钠溶液 |
| C、饱和石灰水中不断通入CO2 |
| D、醋酸中逐滴加入氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |

| 实验编号 | 窗口体积/L | 温度/℃ |
| ① | 1.0 | 1200 |
| ② | 2.0 | 1200 |
| ③ | 2.0 | 1300 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/(kJ?mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
 ,每个COCl2分子内含有
,每个COCl2分子内含有查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)HCNO是一种弱酸,它的酸性类似于醋酸,在水中微弱地电离出H+和CNO-.
(1)HCNO是一种弱酸,它的酸性类似于醋酸,在水中微弱地电离出H+和CNO-.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| B、碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3-+OH-═CO32-+H2O |
| C、常温下,将铜片加入稀硝酸中:Cu+2H+═Cu2++2H2↑ |
| D、氧化亚铁与稀硝酸反应:FeO+2H+═Fe2++H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com