
| A. | 稀HNO3 | B. | CuSO4溶液 | C. | FeCl3溶液 | D. | AgNO3溶液 |
科目:高中化学 来源: 题型:解答题

| 实验 | 1 | 2 | 3 | 4 |
| V(KMnO4)/mL | 19.50 | 21.50 | 19.48 | 19.52 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应不一定有分子碰撞 | B. | 化学反应的活化能一定大于零 | ||
| C. | 具有较高能量的分子是活化分子 | D. | 发生有效碰撞的分子是活化分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | 元素性质或结构 |
| A | 最外层电子数是其内层电子数的2倍 |
| B | B元素的单质在空气中含量最多 |
| C | C元素在地壳中含量最多 |
| D | D元素在同周期中金属性最强 |
| E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
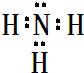 ,属于共价化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式
,属于共价化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式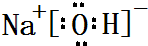 ,所含化学键类型:离子键、共价键.
,所含化学键类型:离子键、共价键.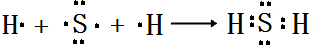 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6a g | B. | (a-1.6)g | C. | (a-3.2)g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥ | B. | 仅②④⑥ | C. | 仅②③④ | D. | ②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根瘤菌把氮气转化为氨 | B. | 氮气和氢气在适宜条件下合成氨 | ||
| C. | 氮气和氧气在放电条件下合成NO | D. | 工业上用氨和二氧化碳合成尿素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
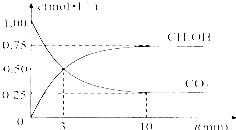 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.| 序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2 通入澄清石灰水中 | B. | Na2CO3溶液和HCl溶液反应 | ||
| C. | AlCl3溶液的NaOH 溶液反应 | D. | 铁丝在氯气中燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com