
| A、98 | B、116 |
| C、158 | D、278 |


科目:高中化学 来源: 题型:
A、溶液的浓度为c=
| ||
| B、用水稀释该溶液,OH- 的物质的量增加 | ||
| C、该溶液中共有6种微粒 | ||
| D、上述溶液中再加入与该溶液体积相等的水后,所得溶液溶质的质量分数小于0.5ω |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、还原性:Fe>Cu>FeCl2 |
| B、还原性:Fe>FeCl2>Cu |
| C、氧化性:CuCl2>FeCl3>FeCl2 |
| D、氧化性:FeCl3>FeCl2>CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
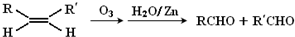

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 开始沉淀时的PH | 完全沉淀时的PH |
| Fe(OH)3 | 1.9 | 3.2 |
| Cu(OH)2 | 4.7 | 6.7 |
| Fe(OH)2 | 6.3 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯碱工业中,阴极区只需加入水 |
| B、电解熔融氯化铝制取金属铝 |
| C、电镀时,用镀层金属作阳极 |
| D、将钢闸门与外电源正极相连,可防止其腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com