
科目:高中化学 来源:不详 题型:单选题
| A.1 mol 硫酸与1mol Ba(OH)2 完全中和所放出的热量为中和热 |
| B.在25℃、101kPa下,1 mol 硫和2 mol硫燃烧热相等 |
| C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 |
| D.101 kPa时,1 mol 碳燃烧所放出的热量为碳的燃烧热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 C、
C、 分别按下式反应(燃烧):
分别按下式反应(燃烧): 放热
放热
 放热
放热
 放热
放热

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
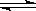 SO3(g) △H = -98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为
SO3(g) △H = -98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为| A.小于196.64kJ | B.196.64kJ/mol | C.196.64kJ | D.大于196.64kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g),下图表示该反应进行过程中的能量变化。
CH3OH(g)+H2O(g),下图表示该反应进行过程中的能量变化。
| A.提高反应速率 | B.提高CO2的转化率 |
| C.降低反应活化能 | D.改变反应的ΔH |
 CH3OH(g)+H2O(g)的化学平衡常数的表达式K=_________。升高温度,K值将_______(填“增大”、“减小”或“不变”)。
CH3OH(g)+H2O(g)的化学平衡常数的表达式K=_________。升高温度,K值将_______(填“增大”、“减小”或“不变”)。 CH3OH(g)+H2O(g)的ΔH="_____" kJ·mol-1
CH3OH(g)+H2O(g)的ΔH="_____" kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.生石灰溶于水 | B.葡萄糖在人体内氧化分解 |
| C.Ba(OH)2·8H2O与NH4Cl反应 | D.锌粒与稀H2SO4反应制取H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.932kJ | B.496kJ | C.738 kJ | D.248 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属锌、石墨碳棒、导线、硫酸铜溶液不能构成原电池 |
| B.吸热反应没有研究价值 |
| C.一个确定的化学反应完成后的结果是吸收能量还是放出能量,决定于反应物的总能量与生成物总能量的相对大小 |
| D.手机充电时,是电能转化为化学能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com