
| A. | △H=-484kJ/mol | B. | △H=+484kJ/mol | C. | 吸收484kJ 能量 | D. | 放出484kJ能量 |
分析 由信息可知,H-H键能为436kJ/mol,O=O键能为496kJ/mol,H-O键能为436kJ/mol,2H2(g)+O2(g)=2H2O(l)中,△H=反应物中键能和-生成物中键能和,以此来解答.
解答 解:常温下拆开1mol H2中的化学键要吸收436kJ的能量,拆开1mol O2中的化学键要吸收496kJ的能量,形成水分子中的1mol H-O键要放出463kJ的能量,则H-H键能为436kJ/mol,O=O键能为496kJ/mol,H-O键能为436kJ/mol,由2H2(g)+O2(g)=2H2O(l)中,△H=反应物中键能和-生成物中键能和=2×436kJ/mol+496kJ/mol-4×463kJ/mol=-484kJ/mol,△H=-484kJ/mol,故选A.
点评 本题考查反应热的计算,为高频考点,把握键能与反应热的关系、焓变正负的意义为解答的关键,侧重分析能力与计算能力的考查,题目难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S的燃烧热为297.23 kJ•mol-1 | |
| B. | S升华是吸热过程 | |
| C. | S(g)+O2(g)═SO2(g)放出的热量小于297.23 kJ | |
| D. | 形成1 mol SO2的化学键释放的总能量大于断裂1 mol S(s)和1 mol O2(g)的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溶液中的阳离子有H+、Mg2+、Al3+、NH4+ | |
| B. | 溶液中n(NH4+)=0.2 mol | |
| C. | 溶液中一定不含CO32-和NO3-,可能含有SO42- | |
| D. | n(H+):n(Al3+):n(Mg2+)=2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
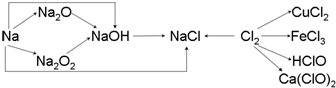
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:
.固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
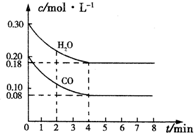 (1)在一容积为10L的容器中,通入一定量的CO和H2O,在850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0,
(1)在一容积为10L的容器中,通入一定量的CO和H2O,在850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0,| t/min | c(CO)/mol•L-1 | c(H2O)/mol•L-1 | c(CO2)/mol•L-1 | c(H2)/mol•L-1 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com