
| A、该电池工作时是把化学能转化为电能 |
| B、LiMOx是该电池的负极 |
| C、其正极反应方程式为:LiyCn-ye-=Cn+yLi+ |
| D、手机往往使用锂电池的原因之一为锂是最轻的金属 |


科目:高中化学 来源: 题型:
| nNA |
| 11.2 |
| A、①②③④⑤ | B、②④⑤ |
| C、②③④ | D、①②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
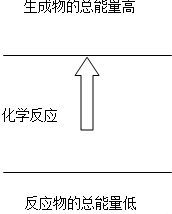
| A、铝片与盐酸的反应 |
| B、盐酸与NaOH溶液的中和反应 |
| C、Ba(OH)2?8H2O与NH4Cl晶体的反应 |
| D、甲烷在氧气中的燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:

A、反应①常温下能进行,其有机产物为 |
| B、反应②不发生,但是仍有分层现象,紫色层在下层 |
| C、反应③为加成反应,产物是三硝基甲苯 |
| D、反应④中1mol苯最多与3mol H2发生加成反应,是因为苯分子含有三个碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O2中只含有极性共价键 |
| B、可用酸性高锰酸钾溶液来区别甲烷和乙烯 |
| C、物质的化学反应与体系的能量变化不一定同时发生 |
| D、铜锌稀硫酸原电池工作时,电子沿外电路从铜电极流向锌电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
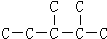 ,此烷烃的一溴代物有
,此烷烃的一溴代物有查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 序号 | 碳酸钙 状态 | C(HCl)/ mol?L-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 块状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 块状 | 0.6 | 20 | 41 | 280 |
| 4 | 粉末 | 0.8 | 20 | 40 | 30 |
| 5 | 块状 | 1.0 | 20 | 40 | 120 |
| 6 | 块状 | 1.0 | 30 | 50 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NO |
| B、FeSO4 |
| C、Fe(NO3)3 |
| D、Fe2(SO4)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com