
| ��-�� |
| 2 |
| 571.2kJ/mol-226.2kJ/mol |
| 2 |


 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д� ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ������ | K+ Ba2+ Fe2+ Al3+ Fe3+ Mg2+ |
| ������ | OH- HCO3- CO32- Cl- NO3- SO42- |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��09-10���Ͼ����и߶���ѧ����ĩ���� ���ͣ������
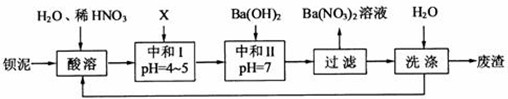
��10�֣�������ҵ�������ų������ı���[��Ҫ����BaCO3 ��BaSiO3�� BaSO3�� Ba(FeO2)2��]��ij��Ҫ����BaCl2��BaCO3 ��BaSO4�Ļ��������ñ�����ȡBa(NO3)2���䲿�ֹ����������£�

��1�����ܺ���Һ��pH=1��Ba(FeO2)2��HNO3�ķ�Ӧ��ѧ����ʽΪ ��
��2������ʱͨ�����Ʒ�Ӧ�¶Ȳ�����70�棬�Ҳ�ʹ��Ũ���ᣬԭ���� �� ��
��3���ó���ϱ���ʵ�ʣ�ѡ�õ�XΪ ���ѧʽ�����к͢�ʹ��Һ�� �������ӷ��ţ���Ũ�ȼ��٣��к͢��������Һ����仯�ɺ��ԣ���
��4������������ϴ�ӵ�Ŀ���� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com