
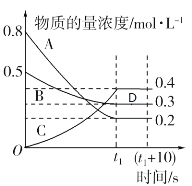
【题目】如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的情况。
试回答下列问题:
(1)该反应的化学方程式为________。
(2)0~t1s内气体B的平均反应速率为________。
(3)(t1+10)s时,B的物质的量分数为______,此时v正(A)_____v逆(B)(填“>”“<”或“=”),D点是否处于平衡状态_________(填“是”或“否”)。
(4)下列关于该反应的说法正确的是________ (填序号)。
a.到达t1时刻该反应已停止
b.在t1时刻之前,气体B的消耗速率大于它的生成速率
c.在t1时刻,气体C的正反应速率等于逆反应速率
(5)容器中(t1+10)s时的压强与起始时的压强之比为____。
【答案】3A+B![]() 2C
2C ![]() 33.33% > 是 bc 9:13
33.33% > 是 bc 9:13
【解析】
由图像可知A、B为反应物,C为生成物,到t1秒时达到化学平衡状态,A物质浓度减小了0.6mol/L,B物质浓度减小了0.2mol/L,C浓度增大了0.4mol/L,三者之比为3:1:2,反应最终反应物和生成物共存,说明该反应是可逆反应,由此可知该反应的化学方程式为3A+B![]() 2C。
2C。
(1)由分析可知该反应的化学方程式为3A+B![]() 2C,故答案为:3A+B
2C,故答案为:3A+B![]() 2C;
2C;
(2)根据速率计算公式,0~t1s内气体B的平均反应速率为v(B)=![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;
(3)在t1时刻该反应已经达到化学平衡状态,此时B的物质的量分数为![]() ,(t1+10)s时,反应已达化学平衡状态,B的物质的量分数不变,仍为33.33%;平衡时A的正反应速率等于逆反应速率,根据化学反应速率之比等于化学计量系数之比,但化学计量系数A>B,则A的正反应速率大于B的逆反应速率;D点处于t1s和(t1+10)s之间,反应已经处于平衡状态,故答案为:33.33%;>;是;
,(t1+10)s时,反应已达化学平衡状态,B的物质的量分数不变,仍为33.33%;平衡时A的正反应速率等于逆反应速率,根据化学反应速率之比等于化学计量系数之比,但化学计量系数A>B,则A的正反应速率大于B的逆反应速率;D点处于t1s和(t1+10)s之间,反应已经处于平衡状态,故答案为:33.33%;>;是;
(4)a.根据图像可知,到达t1时刻该反应已经处于平衡状态,化学平衡状态是动态平衡,该反应没有停止,故a错误;
b.在t1时刻之前,反应正向进行,气体B的消耗速率大于它的生成速率,故b正确;
c.在t1时刻,反应已经达到化学平衡状态,则气体C的正反应速率等于逆反应速率,故c正确;
综上所述,故答案为:bc;
(5)设该容器的容积为VL,起始的总物质的量为(0.8+0.5)Vmol=1.3Vmol,平衡时总物质的量为(0.2+0.3+0.4)Vmol=0.9Vmol,相同条件下,压强之比等于物质的量之比,所以(t1+10)s时的压强与起始时的压强之比为0.9Vmol:1.3Vmol=9:13,故答案为:9:13。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】原子序数依次增大的四种元素A、B、C、D分别处于第1~4周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D原子外围电子排布为3d104s1。请回答下列问题:
(1)这四种元素中电负性最大的是____(填元素符号,下同),第一电离能最小的是____;
(2)C所在的主族元素气态氢化物中,沸点最低的是____(填化学式);
(3)B元素可形成多种单质,其中”只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如图所示,其原子的杂化类型为______;
(4)D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是____(填选项序号);

①极性键 ②非极性键 ③配位键 ④金属键
(5)某学生所做的有关D元素的实验流程如下图:
D单质![]() 棕色的烟
棕色的烟![]() 绿色溶液
绿色溶液![]() 蓝色沉淀
蓝色沉淀![]() 蓝色溶液
蓝色溶液![]() 黑色沉淀
黑色沉淀
请书写第⑤步反应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除杂(括号中的物质是杂质)
方法 | 化学反应方程式 | |
Na2CO3固体(NaHCO3) | _________ | _________ |
NaHCO3溶液(Na2CO3) | _________ | _________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为验证浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO,设计如图装置进行实验(夹持仪器已略去)。(查阅资料):NO与NaOH溶液不反应,NO2与NaOH溶液能反应(反应的化学方程式为2NO2+2NaOHNaNO3+NaNO2+H2O)。
备选药品:浓硝酸、3mol·L-1稀硝酸、蒸馏水、浓硫酸、NaOH溶液及CO2气体。回答下列问题。

(1)连接好装置,滴加浓硝酸之前的操作依次是:____________,加入药品,打开装置①中的弹簧夹后通入CO2一段时间,关闭弹簧夹,将装置④中导管末端伸入倒置的烧瓶内。通入CO2的目的是____________。
(2)若用质量分数为70%浓硝酸(密度为1.42g·cm-3)配制250mL3mol·L-1的稀硝酸,除量筒、烧杯、胶头滴管外,还要用到的玻璃仪器有____________、____________。
(3)装置①中发生反应的化学方程式为____________。
(4)装置①中产生的气体通过盛有水的洗气瓶时发生反应的化学方程式为____________。
(5)根据实验设计,装置②中盛放的试剂是____________。
(6)做实验时应避免有害气体排放到空气中,装置⑤中盛放的药品是____________。
(7)验证浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO的实验现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL 溴乙烷,振荡。
实验操作II:将试管如图固定后,水浴加热。
(1)用水浴加热而不直接用酒精灯加热的原因是_______________________。
(2)观察到__________________________现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)鉴定生成物中乙醇的结构,可用的波谱是___________________________________。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是__________,检验的方法是____________(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中溶质的物质的量浓度为1 mol/L的是( )
A. 将40gNaOH固体溶于1L水中
B. 将22.4 L氯化氢气体溶于水配成1L溶液
C. 将1L 10mol/L的浓盐酸与9L水混合
D. 将10g NaOH固体溶解在水中配成250 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并指出反应类型。
(1)溴苯的制备_________________________________________________(_____________)。
(2)用甲苯制备TNT _____________________________________________(_____________)。
(3)由丙烯制备聚丙烯____________________________________________(_____________)。
(4)溴乙烷与氢氧化钠的乙醇溶液加热______________________________(_____________)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某一密闭且体积不变的容器内有可逆反应A(g)+3B(g)![]() 2C(g)。该反应进行到一定限度后达到了化学平衡,该化学平衡的标志是( )
2C(g)。该反应进行到一定限度后达到了化学平衡,该化学平衡的标志是( )
A.C物质的生成速率和分解速率相等
B.容器内气体的密度不再随时间而改变
C.单位时间内生成amol物质A,同时生成3amol物质B
D.A、B、C的分子数之比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁一空气电池的工作原理如图所示,电池反应为Mg+O2+2H2O=2Mg(OH)2。下列有关该电池的说法不正确的是(已知阴离子交换膜的作用是只允许阴离子通过)( )

A.通入氧气的电极为正极
B.放电时,溶液中的OH-移向负极
C.负极的电极反应式为Mg-2e-+2OH-=Mg(OH)2
D.当电路中转移0.04mol电子时,参加反应的O2为0.02mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com