
硫酸是重要的化工原料,二氧化硫生成三氧化硫是硫酸工业的重要反应之一。将0.100 mol SO2(g)和0.060 mol O2(g)放入容积为2 L的密闭容器中,反应2SO2(g)+O2(g)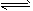 2SO3(g)在一定条件下5分钟末达平衡状态,测得c(SO3)=0.040 mol/L。
2SO3(g)在一定条件下5分钟末达平衡状态,测得c(SO3)=0.040 mol/L。
(1)①5分钟时O2的反应速率是_________;
②列式并计算该条件下反应的平衡常数K=___________。
③已知:K(300℃)>K(350℃),若反应温度升高,SO2的转化率_______(填“增大”、“减小”或“不变”)。
④能判断该反应达到平衡状态的标志是____________。(填字母)
A.SO2和SO3浓度相等
B.容器中混合气体的平均分子量保持不变
C.容器中气体的压强不变
D.SO3的生成速率与SO2的消耗速率相等
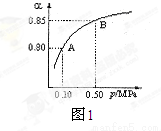
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)___________K(B)(填“>”、“<”或“=”)。
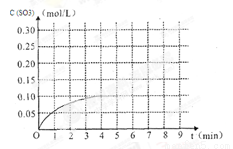
(3)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度约为0.25mol/L)。请在下图中画出此变化过程中SO3浓度的变化曲线。
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源:2014-2015学年上海市五校高三第二学期联考化学试卷(解析版) 题型:选择题
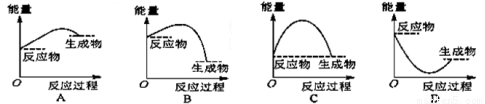
将某固体氢氧化物M与NH4Cl置于如图所示的装置(玻璃片与烧杯底部之间有一薄层水)中混合反应后,用手拿起烧杯时,发现玻璃片与烧杯粘在一起,则该反应所对应的能量变化关系图是

查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二4月月考化学试卷(解析版) 题型:选择题
下列化学用语正确的是
A.醛基的电子式: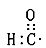
B.丙烷分子的比例模型: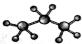
C.三硝基甲苯的结构 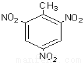
D.2-乙基-1,3-丁二烯分子的键线式: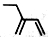
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省太原市高二4月阶段形成检测化学试卷(解析版) 题型:选择题
氯仿(CHCl3)常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2―→2HCl +2COCl2。下列说法不正确的有
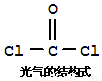
A.CHCl3分子的空间构型为正四面体
B.COCl2分子中中心C原子采用sp2杂化
C.COCl2分子中所有原子的最外层电子都满足8电子稳定结构
D.使用前可用硝酸银稀溶液检验氯仿是否变质
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省太原市高二4月阶段形成检测化学试卷(解析版) 题型:选择题
下列关于离子键的特征的叙述中,正确的是
A.一种离子对带异性电荷离子的吸引作用与其所处的方向无关,故离子键无方向性
B.因为离子键无方向性,故阴、阳离子的排列是没有规律的、随意的
C.因为氯化钠的化学式是NaCl,故每个Na+周围吸引一个Cl-
D.因为离子键无饱和性,故一种离子周围可以吸引任意多个带异性电荷的离子
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二下学期4月阶段性测试化学试卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O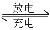 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
A.放电时负极反应为:3Zn-6e-+6OH-====3Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH- FeO42- +4H2O
FeO42- +4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被还原
D.充电时阴极溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二下学期4月阶段性测试化学试卷(解析版) 题型:选择题
使用酸碱中和滴定的方法,用0.01mol/L盐酸滴定锥形瓶中未知浓度的NaOH溶液,下列操作能够使测定结果偏高的是:
A.用量筒量取浓盐酸配制0.01mol/L稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸
B.配制稀盐酸定容时,俯视容量瓶刻度线
C.滴定前尖嘴处无气泡,滴定终点时有气泡
D.滴定过程中用少量蒸馏水将锥形瓶内避粘附的盐酸冲下
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省杭州市下学期高二4月月考化学试卷(解析版) 题型:选择题
下列化合物中,既能发生消去反应生成烯烃,又能发生水解反应的是
A.CH3Cl
B.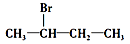
C.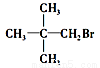
D.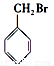
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南市高三4月模拟考试理综化学试卷(解析版) 题型:填空题
选做(12分)【化学——物质结构与性质】A、B、C是中学化学中常见的三种元素(A、B、C代表元素符号)。A位于元素周期表中第4周期,其基态原子最外层电子数为2且内层轨道全部排满电子。短周期元素B的一种常见单质为淡黄色粉末。元素C的原子最外层电子数是其内层电子数的3倍。
(1)在第3周期中,第一电离能大于B的元素有 种;A与B形成晶体的晶胞如图所示,该晶胞实际拥有Bn-的数目为 ;
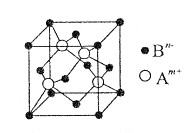
(2)B的氢化物(H2B)分子的空间构型为 ;
在乙醇中的溶解度:sH2C)>s(H2B),其原因是 。
(3)B与C可形成BC42-
①BC42-中,B原子轨道的杂化类型是 。
②人们将价电子数和原子数分别相同的不同分子、离子或原子团称为等电子体。与BC42-互为等电子体的分子的化学式为 (写出一种即可)。
(4)A的氯化物与氨水反应可形成配合物[A(NH3)4]Cl2,l mol该配合物中含有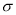 键的物质的量为 mol。
键的物质的量为 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com