
| 数据编号 | 滴入NaOH的体积/mL | 溶液的pH | |
| HX | HY | ||
| ① | 0 | 3 | 1 |
| ② | a | 7 | x |
| ③ | 20.00 | >7 | y |
| A. | 在相同温度下,同浓度的两种酸溶液的导电能力:HX<HY | |
| B. | 由表中数据可估计出Ka(HX)≈10-5 | |
| C. | HY和HX混合,c(H+)=c(X-)+c(Y-)+c(OH-) | |
| D. | 上述反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) |
分析 酸中未加NaOH溶液时,HX溶液中c(H+)<c(HX)=0.1000mol/L,说明HX是弱酸,HY溶液中c(H+)=c(HY)=0.1000mol/L,说明HY是强酸;
A.相同温度下,溶液导电能力与离子浓度成正比;
B.Ka(HX)=$\frac{c({H}^{+}).c({X}^{-})}{c(HX)}$;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.HY是强酸,NaOH是强碱,酸碱的浓度、体积相同且都是一元的,二者混合后恰好完全反应生成强酸强碱盐,溶液呈中性.
解答 解:酸中未加NaOH溶液时,HX溶液中c(H+)<c(HX)=0.1000mol/L,说明HX是弱酸,HY溶液中c(H+)=c(HY)=0.1000mol/L,说明HY是强酸;
A.相同温度下,溶液导电能力与离子浓度成正比,根据以上分析知,HX是弱酸、HY是强酸,相同浓度时离子浓度HX小于HY,所以溶液导电能力HX小于HY,故A正确;
B.Ka(HX)=$\frac{c({H}^{+}).c({X}^{-})}{c(HX)}$≈$\frac{{c}^{2}({H}^{+})}{c(HX)}$≈$\frac{(1{0}^{-3})^{2}}{0.1000}$=10-5,故B正确;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)=c(X-)+c(Y-)+c(OH-),故C正确;
D.HY是强酸,NaOH是强碱,酸碱的浓度、体积相同且都是一元的,二者混合后恰好完全反应生成强酸强碱盐,溶液呈中性,则:c(H+)=c(OH-),根据电荷守恒得:c(Na+)=c(Y-),水的电离很微弱,则溶液中离子浓度大小顺序是:c(Na+)=c(Y-)>c(OH-)=c(H+),故D错误;
故选D.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析判断及对基本概念的理解和运用,注意:电荷守恒与溶质种类多少、溶液浓度都无关,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | V(N2)=0.2 mol•L-1•min-1 | B. | V(H2)=0.1 mol•L-1•min-1 | ||
| C. | V(NH3)=0.15 mol•L-1•min-1 | D. | V(H2)=0.4 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )
某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )| A. | 电子流动方向为a→导线→b | |
| B. | H+经质子交换膜由右向左移动 | |
| C. | 放电一段是时间b极附近pH不变 | |
| D. | a 电极发生反应为:H2N(CH2)2NH2+16e-+4H2O═2CO2↑+N2↑+16H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2(OH)2CO3 $\stackrel{H_{2}SO_{4}}{→}$ CuSO4(aq)$\stackrel{Na}{→}$Cu | |
| B. | 饱和食盐水$\stackrel{NH_{3}+CO_{2}}{→}$NaHCO3 $\stackrel{△}{→}$Na2CO3 | |
| C. | 海水$\stackrel{熟石灰}{→}$ Mg(OH)2 $\stackrel{△}{→}$ MgO $\stackrel{电解}{→}$ Mg | |
| D. | NH3 $→_{催化剂,△}^{O_{2}}$ N2 $\stackrel{O_{2}+H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
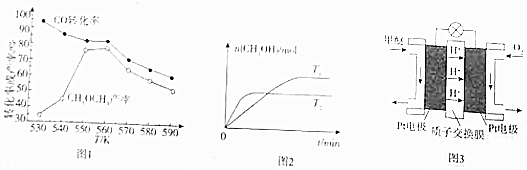
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验步骤 | 现象 | 结论 | |
| A | 取待测液,滴加酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 待测液中可能含Fe2+ |
| B | 将待测气体通入品红溶液中,稍后加热溶液 | 开始品红溶液褪色,加热后又变为红色 | 待测气体中肯定含SO2 |
| C | 取待测液,滴加硝酸酸化的 BaCl2溶液 | 生成白色沉淀 | 待测液中可能含Ag+ |
| D | 将湿润的KI淀粉试纸较长时间置于待测气体中 | 取出后没有观察到试纸变色 | 待测气体中肯定不含Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

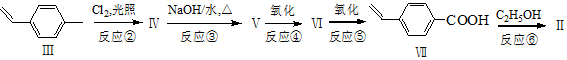
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com