
【题目】磷及其化合物与人类生产、生活密切相关。请回答下列问题:
(1)少量CO的存在会引起生产中催化剂中毒,常用SO2氧化CO,本身被还原为S。
已知:①C (s)+ 1/2O2(g)=CO (g)△H1=-l26.4kJ·mol-1
②C(s)+O2(g) =CO2(g)△H2=-393.5kJ·mol-1
③S(s)+O2(g)=SO2(g)△H3=-296.8kJ·mol-1
则SO2氧化CO的热化学反应方程式__________________________。
(2) CO可用于合成甲醇,反应方程式CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
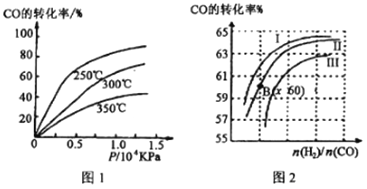
①CO转化率与温度、压强的关系如图所示,该反应△H_____________0 (填“>”或“<”)
图2中曲线I、II、III对应的平衡常数分别为K1、K2、K3,则它们的大小关系为_____________________。
②一定条件下,将2molCO和2molH2置于容积为2L固定的密闭容器中发生上述反应,达到平衡时,CO与H2体积之比为2:1,则平衡常数K=_________________________。
(3)处理高浓度乙醛废水的原理:2CH3CHO+H2O![]() CH3CH2OH+CH3COOH。使用惰性电极电解,以一定浓度的CH3CHO –Na2SO4溶液为电解貭溶液模拟工业处理,其装置如图3所示:
CH3CH2OH+CH3COOH。使用惰性电极电解,以一定浓度的CH3CHO –Na2SO4溶液为电解貭溶液模拟工业处理,其装置如图3所示:

①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别:
4OH--4e-=O2↑+2H2O;_________________________________。
②在实际处现过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入lm3乙醛的含量为300mg L-1的废水,可得到乙醇_____________kg(结果保留2位小数)。
【答案】 SO2(g) +2CO (g) =S(s)+2CO2(g)△H=-237.4kJ ·mol-1 < K1>K2>K3 4.5L2·mol2 CH3CHO+H2O-2e-=CH3COOH+2H+ 0.19
【解析】试题分析:(1)根据盖斯定律计算SO2与CO反应的焓变;(2)根据图像可知,随温度升高CO的转化率增大,平衡正向移动;n(H2)/n(CO)一定时,CO的转化率Ⅰ>Ⅱ>Ⅲ,转化率高的平衡常数大;②利用“三段式”计算平衡常数;(3)①阳极发生氧化反应,乙醛被氧化为乙酸,氢氧根离子被氧化为氧气;②根据阴极反应CH3CHO+2e-+2H+=CH3CH2OH计算乙醇的质量。
解析:(1)①C (s)+ 1/2O2(g)=CO (g)△H1=-l26.4kJ·mol-1
②C(s)+O2(g) =CO2(g)△H2=-393.5kJ·mol-1
③S(s)+O2(g)=SO2(g)△H3=-296.8kJ·mol-1
根据盖斯定律得,目标方程式=②×2-①×2-③,ΔH=(-393.5kJ·mol-1)×2-(-126.4kJ/mol)×2-(-296.8kJ·mol-1)=-237.4kJ·mol-1,所以所求热化学方程式为SO2(g)+2CO(g)=S(s)+2CO2(g) ΔH=-237.4kJ·mol-1;(2)①由图1可知,温度升高CO的转化率降低,说明升高温度,平衡逆向移动,正向是放热反应,ΔH<0;n(H2)/n(CO)一定时,CO的转化率Ⅰ>Ⅱ>Ⅲ,转化率高的平衡常数大,所以K1、K2、K3的大小关系为K1>K2>K3;②
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
开始 1 1 0
转化 x 2x x
平衡 1-x 1-2x x
根据题意(1-x):(1-2x)=2:1
x=![]()
K=![]() =4.5L2·mol2;
=4.5L2·mol2;
(3)①阳极发生氧化反应,乙醛被氧化为乙酸,氢氧根离子被氧化为氧气,所以阳极电极反应式除生成氧气外,还有CH3CHO-2e-+H2O═CH3COOH+2H+
②阴极反应是CH3CHO+2e-+2H+=CH3CH2OH,所以注入1m3乙醛的含量为300mg/L的废水,阴极区乙醛的去除率可达60%,生成乙醇的质量是1000L×300mg/L×60%×10-3g/mg÷44g/mol×46g/mol=188.2g=0.19kg


科目:高中化学 来源: 题型:
【题目】甲元素的原子序数是19,乙元素原子核外有两个电子层,最外电子层上有6个电子,丙是元素周期表中第ⅠA族中金属性最弱的碱金属元素.由此推断:
(1)甲元素在周期表中位于第周期;乙元素在周期表中位于第族,丙元素的名称为 .
(2)甲的单质与水反应的离子方程式为 , 乙与丙单质加热反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为短周期元素,X的一种核素的质子数为8;Y和Ne原子的原子核外电子数相差1;Z的单质是一种常见的半导体材料;W的非金属性在同周期元素中最强。其原子半径随原子序数的变化如图所示。下列说法不正确的是
A. ZX2为酸性氧化物,只能与碱溶液反应
B. 简单氢化物的热稳定性:Z<W
C. 化合物YWX中既含离子键,又含共价键
D. W的最高价氧化物对应的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2溶液中逐滴加入稀硫酸,若缓缓加入稀硫酸直至过量,整个过程中混合溶液中的导电能力(用I表示)可近似地用下图中的曲线表示的是( ) 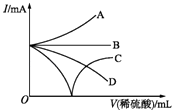
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①pH=2的CH3COOH溶液;②pH=2的H2SO4溶液;③pH=12的氨水;④pH=12的NaOH溶液。室温条件下,有关上述溶液的比较中,正确的是( )
A. 水电离的c(H+):①=②=③=④
B. 将②、④溶液混合后,pH=7,消耗溶液的体积:②<④
C. 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D. 向10 mL上述四溶液中各加入90 mL水后,溶液的pH:③>④>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质。下列说法正确的是
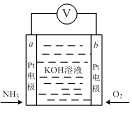
A. 电化学气敏传感器工作时,c(K+)保持不变
B. 电化学气敏传感器工作时,电子流向a→b→a
C. 当外电路通过0.15 mol电子时,反应消耗的NH3为0.05mol
D. 电极a反应式为:2NH3 + 6e﹣+ 6OH﹣= N2↑+ 6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com