
 3C(g)����2 s��ﵽƽ�⣬���C�����Ũ��
3C(g)����2 s��ﵽƽ�⣬���C�����Ũ��| A���٢ڢۡ����� | B���٢ۡ������� | C���ڢ� | D���٢ۢ� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 C(��) ������ӦΪ���ȷ�Ӧ���ﵽƽ���������ͼ���жϣ�
C(��) ������ӦΪ���ȷ�Ӧ���ﵽƽ���������ͼ���жϣ�
| A�� | B�� | C�� | D��E�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
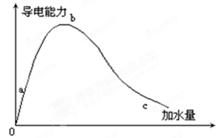
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢� | B���٢� | C���ڢ� | D���ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
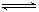 CO2(g)��H2(g) ��H <0,200��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ1/2.25,���¶��£���һ������CO��H2Ͷ��ij10L�ܱ�������5minʱ��ƽ�⣬������Ũ��(mol?L��1)�仯���£�
CO2(g)��H2(g) ��H <0,200��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ1/2.25,���¶��£���һ������CO��H2Ͷ��ij10L�ܱ�������5minʱ��ƽ�⣬������Ũ��(mol?L��1)�仯���£�| | 0min | 5min | 10min |
| CO | 0.01 | | 0.0056 |
| H2O | 0.01 | | 0.0156 |
| CO2 | 0 | | 0.0044 |
| H2 | 0 | | 0.0044 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������1mol����������ͬʱ��Ҳ����1mol���� |
| B�����ᡢ�Ҵ�������������Ũ����ͬ |
| C��������Ͽ�1mol̼��������ͬʱ���Ҵ�Ҳ�Ͽ���1mol������ |
| D��������Ͽ�1mol��������ͬʱ���Ҵ�Ҳ�Ͽ���1mol̼������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
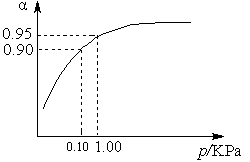
 2SO3(g) ��H ="-98.3" kJ��mol-1��
2SO3(g) ��H ="-98.3" kJ��mol-1��| �� �� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 2 mol SO2��1 mol O2 | 2 mol SO3 | m mol SO2��n mol O2�� p mol SO3 |
| c(SO3) /mol��L-1 | 1.4 | 1.4 | 1.4 |
| �����仯 | �ų�a kJ | ����b kJ | ����c kJ |
| SO2��SO3��ת���� | ��1 | ��2 | 12.5% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
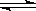 H2O��g��������Ҳ������ƽ���ƶ�ԭ����������һ�仯�е�һЩ���⣬�磺H2O
H2O��g��������Ҳ������ƽ���ƶ�ԭ����������һ�仯�е�һЩ���⣬�磺H2O �����������ȹ��̣������¶����ߣ�ƽ�������ɸ����H2O��g���ķ����ƶ�����ش������������⣺
�����������ȹ��̣������¶����ߣ�ƽ�������ɸ����H2O��g���ķ����ƶ�����ش������������⣺ �ͣ�����ѹ����ˮ�ķе����ͨ����ˮ�ķе� �����ͣ���
�ͣ�����ѹ����ˮ�ķе����ͨ����ˮ�ķе� �����ͣ����鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com