
科目:高中化学 来源: 题型:实验题
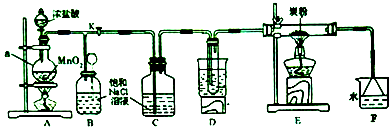
 利用如图装置可验证同主族元素非金属性的变化规律.
利用如图装置可验证同主族元素非金属性的变化规律.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在日常生活中,造成钢铁腐蚀的主要原因是化学腐蚀 | |
| B. | MgO、Al2O3是耐高温材料,工业上常用其电解冶炼对应的金属 | |
| C. | 明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| D. | 纯碱可用于生产普通玻璃,日常生活中也可用热的纯碱溶液来除去物品表面的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Y<Z<W | |
| B. | X和Y两种元素可形成多种二元化合物 | |
| C. | X、Z和W三种元素形成的化合物属于强电解质 | |
| D. | 元素的非金属性:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
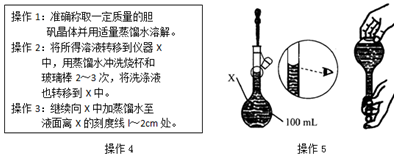
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a=b,则m+n<14 | |
| B. | 若a=b,则HX一定是弱酸 | |
| C. | 反应后溶液中一定存在c(Na+)>c(X-)>c(OH-)>c(H+) | |
| D. | 若a=2b,则反应后溶液中一定存在2c(OH-)=c(HX)+2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X为0.05 mol•L-1 | B. | Y为0.1 mol•L-1 | C. | Z为0.2 mol•L-1 | D. | W为0.1 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com