
(1)通过计算确定原混合气体的成分。
(2)计算原混合气体中各组分的体积。
(1)C2H6与CH4的混合气体
(2)V(C2H6)=0.448 L,V(CH4)=0.896 L
解析:(1)n(NaOH)=0.24 L×0.500 mol·L-1=0.12 mol。
设所得7.60 g固体中,含有Na2CO3和NaHCO3的物质的量分别为x、y,根据题意有:
2x+y=0.12 mol(钠元素守恒)
106 g·mol-1x+84 g·mol-1y=7.60 g(所得固体质量)
由此求出:x=0.04 mol,y=0.04 mol。
则碳元素的物质的量为
0.04 mol+0.04 mol=0.08 mol
n混烃=![]() =0.06 mol,混合烃中碳原子的平均值为=
=0.06 mol,混合烃中碳原子的平均值为=![]() 。
。
其中一种组分是乙烷(分子式中碳原子数为2,大于![]() ),根据平均值原理可知,另一种组分的分子式中的碳原子数必小于
),根据平均值原理可知,另一种组分的分子式中的碳原子数必小于![]() ,一定是甲烷,即原混合烃由CH4和C2H6组成。
,一定是甲烷,即原混合烃由CH4和C2H6组成。
(2)设原混合烃中,CH4为a mol,C2H6为b mol,则有:
a+b=0.06(混合烃的总物质的量)
a+2b=0.08(混合烃中的碳元素)
求得a=0.04,b=0.02。
所以原混合烃中各组分的体积分别为:
V(CH4)=0.896 L,V(C2H6)=0.448 L。


科目:高中化学 来源: 题型:阅读理解
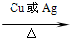 2CH3CHO+2H2O
2CH3CHO+2H2O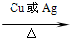 2CH3CHO+2H2O
2CH3CHO+2H2O| 水浴加热 |
| 水浴加热 |
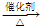
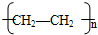 ,
,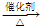
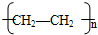 ,
,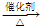 CH3CH2Cl,
CH3CH2Cl,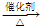 CH3CH2Cl,
CH3CH2Cl, CH3COOC2H5+H2O,
CH3COOC2H5+H2O, CH3COOC2H5+H2O,
CH3COOC2H5+H2O,查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
①能使溴水褪色;②不可能有乙炔;③肯定有甲烷;④10 mL此状况下的混合气可与同状况下20 mL氢气加成;⑤可能有乙烷.
A.②③④
B.②④⑤
C.①②③
D.③④⑤
查看答案和解析>>
科目:高中化学 来源:新课程模块教与练·高中化学必修2(苏教版) 苏教版 题型:038
在标准状况下,乙烷与某烃的混合气体1.344 L,与足量的氧气混合后点燃,充分反应后,将所得气体通入300 mL 0.4 mol/L的氢氧化钠溶液中,将气体完全吸收后,所得溶液在减压低温下蒸干,此时可得不含结晶水的固体7.6 g.若蒸发的过程中溶质不发生分解,试推断:原混合气体中某烃的分子式,并求出它的体积分数.
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)某有机物A在氧气中燃烧时,只生成CO2和水蒸气,经测定A中碳的质量分数为40,氢的质量分数为6.67。A的蒸气密度是相同状况下乙烷气体密度的3倍,试回答下列问题:
(1)A的分子式为 。
(2)若9.0g与足量钠反应可产生2.24L标准状况下的氢气,每9.0gA与乙醇恰好完全反应可生成0.1mol酯和1.8g水,则A中所含的官能团名称为 。
(3)经红外光谱测定A在催化剂存在时可被氧气氧化成一种二元酸,则A的结构简式为 。
(4)A与浓硫酸共热时可生成酯,其分子式为C6H8O4的结构简式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com