
【题目】下列各组离子在溶液中能大量共存的是( )
A.H+、Na+、HCO3-、NO3-B.Ag+、NO3-、Cl-、Na+
C.Na+、Mg2+、SO42-、Cl-D.Na+、H+、OH-、ClO—
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】以有机物A为基础物质,可以通过不同的反应制得下列物质。
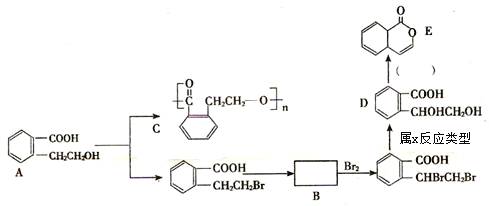
(1)写出A→C的化学方程式:__________________________________________。
(2)推断B物质的结构简式______________________;X反应类型是___________;由 D → E 所需的试剂是_______________________________。
(3)R物质属于A 的同分异构体,其性质如下:
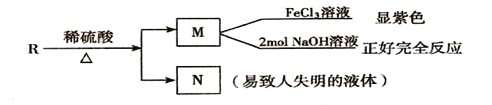
试写出符合条件的R的同分异构体的结构简式(任写两种):__________;________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是
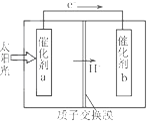
A. 该过程是将太阳能转化为化学能的过程
B. 催化剂a表面发生氧化反应,有O2产生
C. 催化剂a附近酸性减弱,催化剂b附近酸性增强
D. 催化剂b表面的反应是CO2+2H++2e一=HCOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有K2Cr2O7的废水具有较强的毒性,工业上常用钡盐沉淀法处理含有K2Cr2O7的废水并回收重铬酸,具体的流程如下:
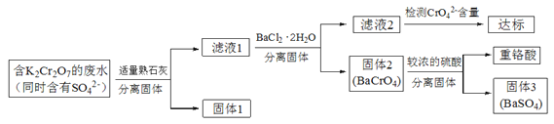
已知:i. CaCr2O7、BaCr2O7易溶于水,其它几种盐在常温下的溶度积如下表所示。
物质 | CaSO4 | CaCrO4 | BaCrO4 | BaSO4 |
溶度积 |
|
|
|
|
ii. Cr2O72-+ H2O![]() 2 CrO42-+ 2H+
2 CrO42-+ 2H+
(1)向滤液1中加入BaCl2·H2O的目的,是使CrO42-从溶液中沉淀出来。
①结合上述流程说明熟石灰的作用是_______________________________。
②结合表中数据,说明选用Ba2+而不选用Ca2+处理废水的理由是________________。
③研究温度对CrO42-沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度下CrO42-的沉淀率![]() ,
,
如下图所示。
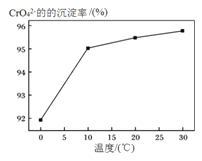
已知:BaCrO4(s) ![]() Ba2+ (aq) + CrO42-(aq)
Ba2+ (aq) + CrO42-(aq)
CrO42-的沉淀效率随温度变化的原因是___________________________________。
(2)向固体2中加入硫酸,回收重铬酸。
① 硫酸浓度对重铬酸的回收率如下图(左)所示。结合化学平衡移动原理,解释使用0.450 mol/L的硫酸时,重铬酸的回收率明显高于使用0.225 mol/L的硫酸的原因是_________________________________。
② 回收重铬酸的原理如下图(右)所示。当硫酸浓度高于0.450 mol/L时,重铬酸的回收率没有明显变化,其原因是_______________________________。
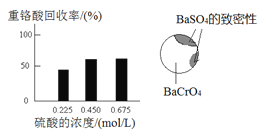
(3)综上所述,沉淀BaCrO4并进一步回收重铬酸的效果与___________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:

请回答:
(1)胆矾的化学式为___________。
(2)写出反应①的化学方程式____________________,反应②生成沉淀的离子方程式____________________。
(3)为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选):__________________________________。
(4)在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是_______________________________________________。
(5)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和试剂Y制胆矾晶体,试剂Y为具有强氧化性的无色液体,则反应④的总化学方程式为___________;若不考虑绿色化学工艺, 试剂Y可选1 mol·L-1的硝酸,欲使3 mol Cu全部溶解且溶液中含铜元素的溶质仅为CuSO4,则需该硝酸的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
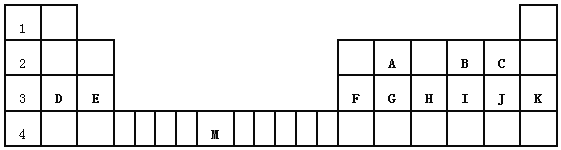
(1)除稀有气体外第三周期中原子半径最小的是_____(填元素符号)
(2)表中用字母标出的12种元素中,化学性质最不活泼的是_____(用元素符号表示,下同),金属性最强的是___(用元素符号表示),属于过渡元素的是___(该空格用表中的字母表示)
(3)元素B的单质含有的化学键为_____。(填“离子键’’、“极性共价键”、“非极性共价键”)
(4)D、F元素最高价氧化物对应水化物相互反应的离子方程式为_____________
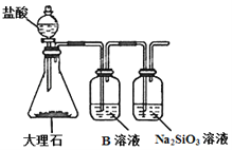
(5)为比较元素A和G的非金属性强弱,用图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_________,能说明A和G非金属性强弱的化学方程式是:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着资源的开发和现代化工业的发展,你认为减少酸雨以保护环境可采取的措施是( )
①尽量少用煤作燃料 ②把工厂的烟囱加高 ③将燃料脱硫后再燃烧
④开发新的清洁能源 ⑤植树造林 ⑥在已酸化的土壤中加石灰
A.①②③④B.③④⑤⑥C.①③④D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于离子反应,又属于氧化还原反应的是( )
A. NaOH溶液与盐酸中和B. Zn与CuSO4 溶液的反应
C. 分解氯酸钾制氧气D. MgCl2溶液 与KOH溶液产生沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com